Nutriční péče pro každého
Desatero nutriční péče
Principy nutriční péče, které by měl znát a používat každý lékař.
1. Definice a klasifikace
Malnutrice je stav nedostatečného přívodu nutrientů nebo jejich utilizace spojený se somatickými projevy a funkčním deficitem. Má 2 typy: malnutrice prostá a malnutrice spojená s nemocí.
2. Epidemiologie
Malnutrice postihuje především seniory. Postihuje až 40 % pacientů v nemocnici a 10–15 % v komunitě.
3. Etiologie a patofyziologie
Nedostatečný příjem potravy, přítomnost zánětlivé reakce, přítomnost chronických onemocnění, funkční deficit.
4. Anamnéza
Příjem potravy, změny hmotnosti, změny funkčního stavu, sociální anamnéza, konkomitantní onemocnění.
5. Fyzikální vyšetření
Kromě komplexního vyšetření pacienta i vyšetření nutričního stavu: svalová hmota, svalová síla, funkční vyšetření, kognitivní funkce.
6. Diagnostické metody
Screeningové nástroje, funkční vyšetření, laboratorní vyšetření, metody vyšetření tělesného složení.
7. Farmakoterapie
Dieta (dietní systém), suplementa, enterální výživa, parenterální výživa.
8. Intervenční léčba
Nutriční opatření. Úprava perorálního příjmu, orální suplementa, enterální výživa, parenterální výživa, fyzioterapie.
9. Komplikace
Malnutrice je nezávislá riziková proměnná morbidity a mortality. Ztráta soběstačnosti, komplikace probíhajícího onemocnění, zhoršené hojení ran.
10. Prognóza
Prostá malnutrice má dobrou prognózu při aplikaci vhodné nutriční strategie. Malnutrice spojená s nemocí je prognosticky závažný stav potencující progresi základního onemocnění.
Praktické informace


Diagnostika malnutrice
Co je malnutrice
Malnutrice je zhoršený stav výživy způsobený v různé míře kombinací nedostatečného příjmu živin nebo přítomností systémového zánětu, který vede ke změnám tělesného složení, poklesu fyziologických funkcí a zhoršenému klinickému stavu. Malnutrice patří podle terminologie Evropské společnosti klinické výživy a metabolismu (ESPEN) do skupiny nutričně podmíněných patologických stavů spolu s nadváhou, obezitou, poruchami mikronutrientů (karence nebo toxicita) a realimentačním syndromem. Do stejné skupiny jsou řazeny sarkopenie a stařecká křehkost (frailty), které však díky své komplexní patogenezi patří mezi stavy tzv. nutričně spolupodmíněné.

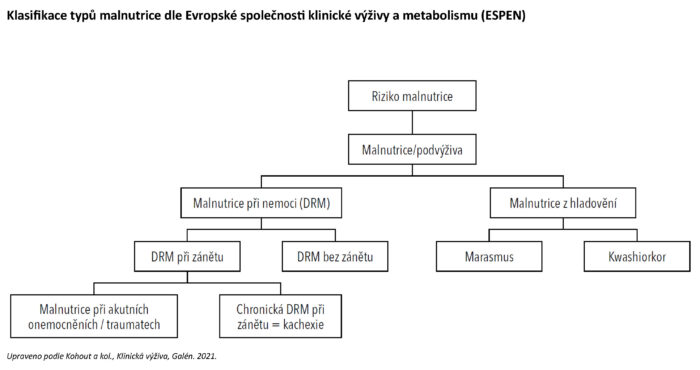
Klasifikace typů malnutrice
Malnutriční stavy se dělí podle přítomnosti onemocnění s různou intenzitou stresového metabolizmu nebo prostého hladovění na malnutrici při onemocnění (z anglického disease-related malnutrition, DRM) a malnutrici bez přítomného onemocnění. V kategorii malnutrice při nemoci je důležitým činitelem aktivita zánětu a podle ní se dále dělí. Záleží i na povaze zánětlivého stavu, zda se jedná o intenzivní akutní zánět, malnutrici při akutních onemocněních nebo o tlumenější chronickou zánětlivou variantu.
Malnutrice při chronických zánětlivých onemocněních se označuje také jako kachexie. Pokud se DRM rozvíjí s minimální přítomností zánětu, hovoříme o nekachektizující formě, která je velmi podobá prostému hladovění. Marasmus a kwashiorkor jsou v aktuální klasifikaci malnutrice podle ESPEN ponechány pouze jako podjednotky v kategorii prostého hladovění a nikoli v souvislosti s malnutricí při nemoci.
Jak identifikovat malnutrici?
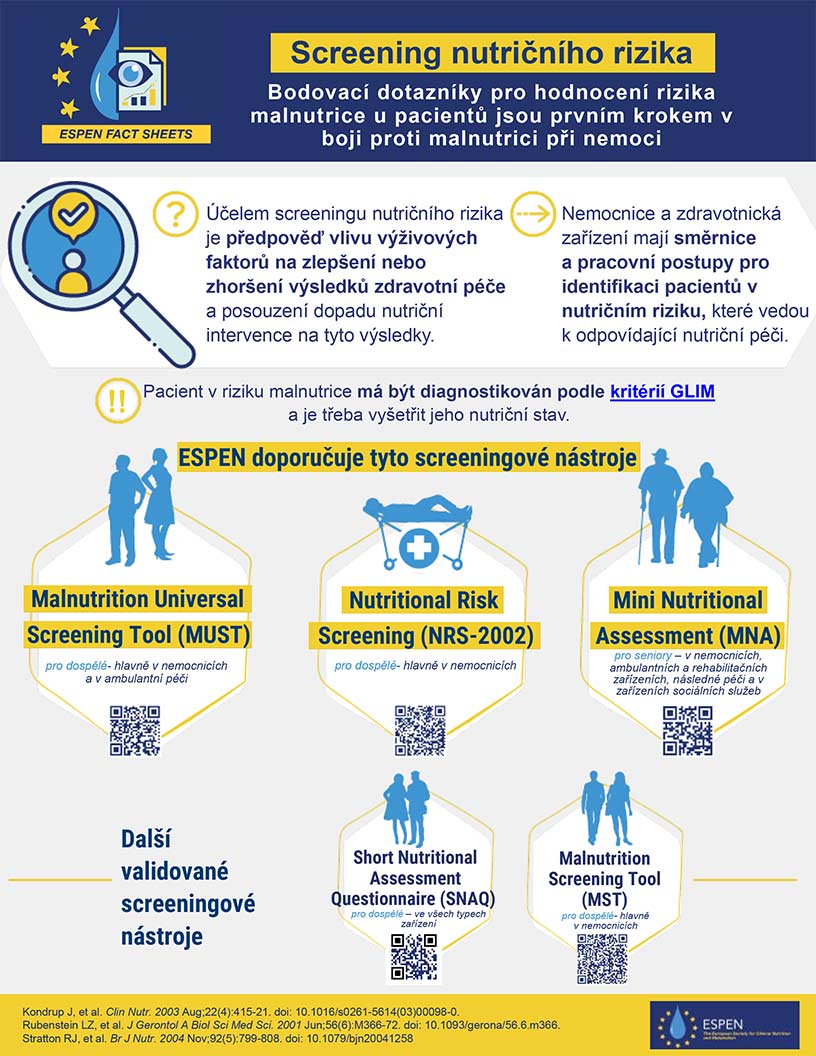
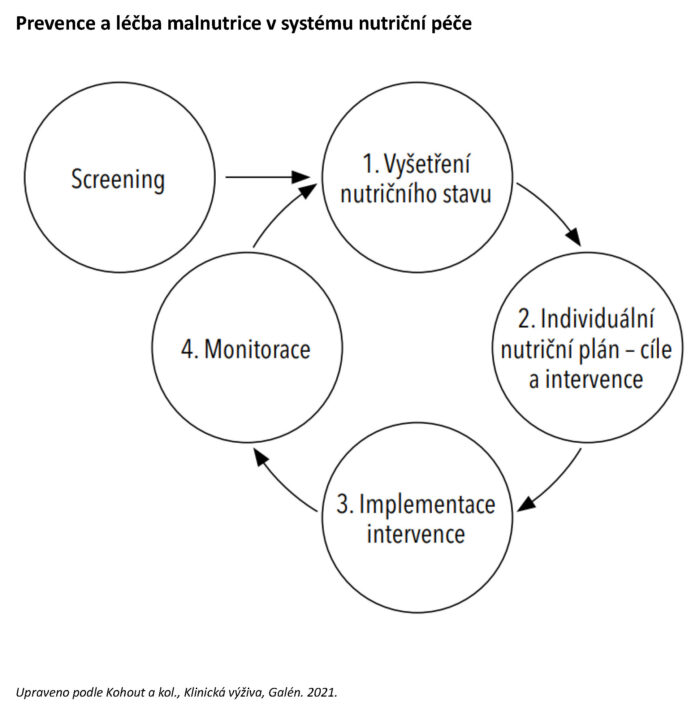
Vyšetření nutričního stavu je založeno především na sledování antropometrických, fyzikálních a biochemických parametrů. Z tohoto hlediska jsou velmi důležité standardizované nástroje nutričního screeningu, kdy jejich aplikace spolu s cíleným vyšetřením nutričního stavu umožňuje včasnou intervenci podle individuálních potřeb pacienta.
Nutriční screening je velmi důležitý pro včasnou intervenci u jedinců s potvrzením diagnózy malnutrice při navazujícím klinickém vyšetření. Nástroje nutričního screeningu jsou velmi jednoduché, rychlé, levné, ale současně standardizované a validované pro daný účel. Screeningové nástroje nutričního rizika charakterizuje požadovaná míra senzitivity, specifity a pokud možno též predikční hodnota ve vztahu k úspěchu nutriční intervence. Nutriční screening je součástí klinických protokolů v rámci ambulantní nebo hospitalizační péče a v případě pozitivního výsledku s jasně definovaným plánem dalšího postupu. Pro příklad zde uvádíme tři nástroje, které jsou doporučovány ESPEN:
1. Nutritional Risk Screening 2002 (NRS-2002) určený pouze pro hospitalizované pacienty;
2. Malnutrition Universal Screening Tool (MUST) pro ambulantní i hospitalizované pacienty, viz kalkulačku;
3. Mini Nutritional Assessment (MNA) pro seniory v pobytových zařízeních sociálních služeb.
Dále doporučujeme screening Pracovní skupiny pro nutriční péči v onkologii (PSNPO) jako specifický nástroj pro onkologické pacienty.
K identifikaci pacientů v riziku malnutrice na JIP je možné použít NUTRIC Score System.
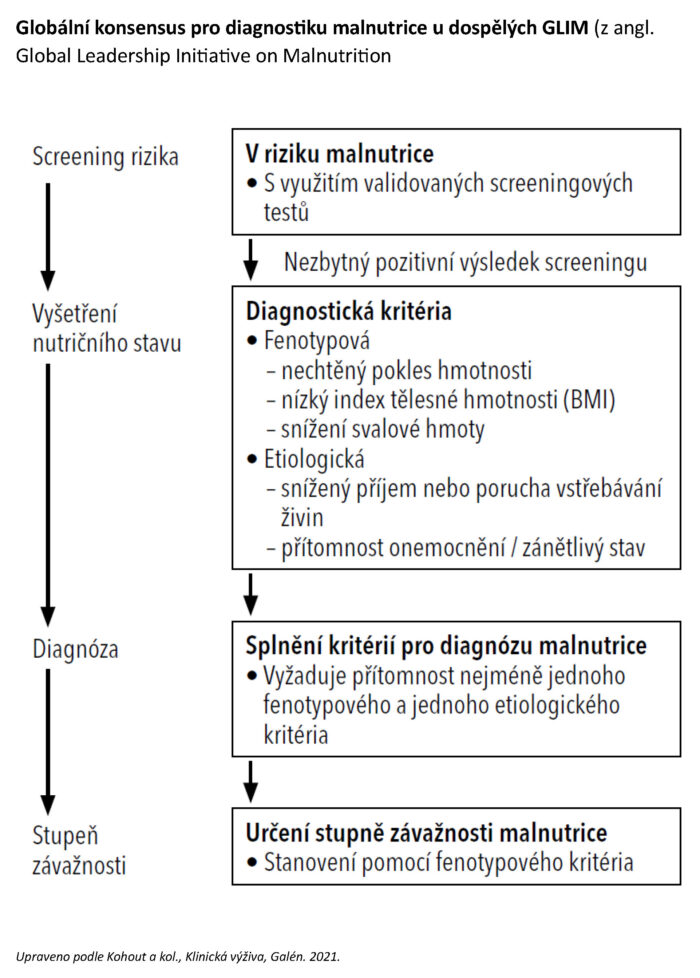
Jak vyšetřit nutriční stav a diagnostikovat malnutrici?
Vyšetření nutričního stavu je v souladu s diagnostikou malnutrice podle GLIM (Global Leadership Initiative on Malnutrition) indikováno u všech pacientů s pozitivním výsledkem nutričního screeningu a také vždy jako součást diagnostiky i ostatních nutričně podmíněných patologických stavů. Nutriční riziko je automaticky posouzeno u všech pacientů (celoplošně) jako první krok (při ambulantním vyšetření, přijetí k hospitalizaci) a následně ve stanovených, většinou pravidelných intervalech (tzv. rescreening). Při cíleném nutričním vyšetření jsou získány potřebné informace ke stanovení diagnózy nutričně podmíněné poruchy, její klasifikace a stanovení závažnosti. Při vyšetření se jako základ stanovují obdobné parametry jako u nutričního screeningu, ale podrobněji a v rámci podstatně širšího spektra parametrů. Důležitou součástí nutričního vyšetření jsou nutriční anamnéza a nutriční bilance, které zahrnují kvalitativní i kvantitativní analýzy příjmu stravy, bilanci příjmu energie, bílkovin a podle potřeby i dalších živin.
Klinické vyšetření
Klinické vyšetření, zejména to fyzikální, které postihuje řadu projevů malnutrice, je základní součástí posouzení nutričního stavu. Základní parametry fyzikálního vyšetření, jako je BMI nebo změna tělesné hmotnosti, jsou součástí nutričního screeningu a diagnostiky malnutrice podle kritérií GLIM. Interpretace fyzikálních nálezů zkušeným klinikem v kontextu anamnézy a dalších pomocných vyšetřovacích metod má zásadní význam pro správné zhodnocení nutričního stavu, diagnostiku malnutrice, poruch metabolismu specifických živin a zejména karenčních stavů. Komplexní vyšetření nutričního stavu je nezbytným předpokladem pro správnou indikaci nutriční intervence, odhad rizika vzniku komplikací a jejich efektivní prevenci.
Stanovení tělesného složení
Tělesná hmotnost, její pokles, výpočet BMI (body mass index = kg/m2) a další antropometrické parametry jsou důležité při základním vyšetření nutričního stavu. BMI nezohledňuje tělesné složení. Normální hodnoty BMI jsou 20–25, hodnoty pro podváhu jsou nižší než 18,5, pro nadváhu 25–30 a obezitu nad 30.
Pomocné vyšetřovací metody stanovení tělesného složení v závislosti na použitém modelu popisují tělesné kompartmenty jako tukovou hmotu, netukovou hmotu, svalovou hmotu a kostní hmotu. Bez stanovení svalové hmoty není možná diagnostika sarkopenie a sarkopenické obezity. Tělesné složení se mění v průběhu nemoci, s věkem, při malnutrici, ale i při fyzické aktivitě. Pro stanovení tělesného složení v rámci diagnostiky malnutrice a ostatních nutričně podmíněných poruch lze v běžné klinické praxi použít zejména bioelektrickou impedanci (BIA). Je velice jednoduchá, relativně levná a neinvazivní metoda odhadu tělesného složení. Pro tyto vlastnosti je velice vhodná pro klinickou praxi.
Funkční vyšetření v diagnostice malnutrice
Malnutrice způsobuje měřitelné poruchy fyziologických funkcí, jako jsou svalová síla, kognitivní funkce, soběstačnost, mobilita nebo imunologické testy oddálené přecitlivělosti. Poruchy těchto funkcí mohou vést ke snížení schopnosti (soběstačnosti) si obstarat, připravit a následně i konzumovat potravu. Proto je funkční vyšetření velmi důležitou součástí nutričního vyšetření.
Forma testů se značně liší, jde o prosté dotazování se na funkce v rámci anamnézy, měření síly stisku ručním dynamometrem a vícefázové testy vyšetření funkcí polykání, které testují komplexní fyzické a kognitivní procesy. Sílu stisku ruky lze využít pro sledování trendů při opakovaném vyšetření jedince v čase, ale hodnoty je vhodné porovnat i s normou pro daný věk a pohlaví. Výhodou tohoto vyšetření je jeho snadná dostupnost. V rámci úspěšné realimentace je zlepšení síly stisku ruky umožněno bez měřitelného nárůstu svalové hmoty jen díky doplnění zásob energie a živin ve svalové tkáni nezbytných pro správnou nervosvalovou funkci.
Energetický deficit má vliv na svalovou sílu, ale i celkovou fyzickou kondici. Z toho vyplývá, že vyšetření svalové síly je velmi důležité v rámci diagnostiky malnutrice podle kritérií GLIM. Pokud je svalová síla v normě, je nepravděpodobný významný deficit svalové hmoty. Přehled vybraných testů svalové síly a výkonnosti včetně referenčních mezí je uveden zde.
Laboratorní diagnostika
Neexistuje laboratorní parametr, jehož stanovení by samo o sobě určilo diagnózu malnutrice nebo jiné nutričně podmíněné poruchy a které by samostatně sloužilo k monitorování účinku nutriční podpory. Konkrétní panely laboratorních vyšetření (krevní obraz, lipidogram, mineralogram, jaterní testy atd.) nám přesto pomáhají blíže specifikovat nutriční stav pomocí průkazu hladin jednotlivých živin, objasněním etiologie malnutrice, monitorováním průběhu realimentace, určením orgánových funkcí a stanovením intenzity zánětlivé odpovědi.
Zejména u chronické malnutrice laboratorní vyšetření detekuje karence mikronutrientů, jak vitaminů (C, D, E, K, B1, B6, B12 a kyselina listová), tak stopových prvků (zinek, selen, železo) a pomáhá i v průběhu jejich substituce. Pro prevenci realimentačního syndromu je nezbytné laboratorní monitorování hladiny a odpadů draslíku, magnezia a fosforu v časné fázi realimentace. Většina ze zmiňovaných laboratorních parametrů je kromě nutričního stavu ovlivňována i dalšími faktory. Proto se jejich hodnocení vždy provádí v kontextu s klinickým stavem.
Více o laboratorním vyšetření zde.
Příčiny a důsledky malnutrice
Etiopatogeneze malnutrice
Zjištění patofyziologických příčin malnutrice, zejména stanovení intenzity zánětlivé odpovědi, umožňuje odlišení stavů s dominantním podílem hladovění od primární kachexie, která se rozvíjí jako následek chronického zánětlivého onemocnění. Závažnost onemocnění vždy nekoresponduje s přítomností a intenzitou zánětlivé odpovědi. Typickými příklady onemocnění s výrazným vlivem na příjem potravy a relativně nízkou aktivitou zánětu jsou např. mentální anorexie nebo neurogenní poruchy polykání v důsledku cévních mozkových příhod nebo neurodegenerativních onemocnění. Identifikace těchto případů má mimořádný klinický význam, protože nutriční podpora má u nich podstatně vyšší efektivitu při zachování svalové hmoty a tělesné hmotnosti než u stavů s intenzivním systémovým zánětem.
Zánět je nezbytnou univerzální reakcí na nemoc, poranění nebo operaci. Pokud je zánět intenzivní nebo trvá po delší časové období, způsobuje výraznou ztrátu netukové tělesné hmoty a zadržování tekutin v extracelulárním prostoru. Již existující zánět zhoršuje efektivitu odpovědi na další inzult, vede k poruchám hojení a zhoršuje prognózu nemocných. Toto platí zejména u infekční etiologie zánětu.
Přítomnost a intenzitu zánětlivé odpovědi, která ovlivňuje chuť k jídlu, příjem stravy i schopnost trávit a vstřebávat živiny, lze diagnostikovat podle základních laboratorních parametrů, jako jsou snížené hladiny hemoglobinu, albuminu, prealbuminu a zvýšená hladina C-reaktivního proteinu. Základním rozdílem mezi prostým hladověním a stresovým katabolismem malnutrice při nemoci je (ne)přítomnost zánětu. Ta výrazně ovlivňuje míru zapojení jednotlivých metabolických cest a využití hlavních metabolických substrátů jako zdrojů energie. Během prostého hladovění jsou hlavním zdrojem energie tuky, za stresového metabolismu je nezbytně odbouráván svalový protein.

Klinické důsledky a ekonomické aspekty malnutrice
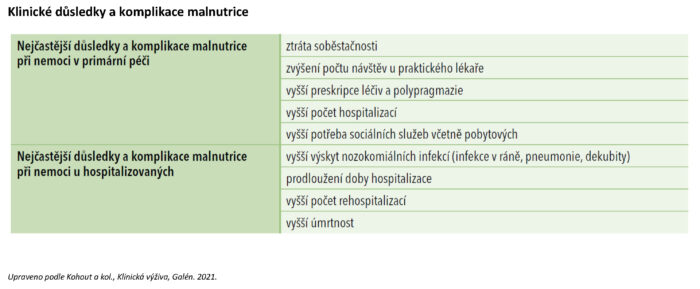
Malnutrice při nemoci se vyskytuje u 20–50 % hospitalizovaných pacientů. Její následky lze pozorovat ve zvýšené morbiditě a mortalitě, delší době hospitalizace, snížené kvalitě života a zhoršených tělesných funkcích a rovněž v růstu nákladů na nemocniční péči. V dostupných studiích sledujících nákladovou efektivitu nutričních intervencí se ukazuje, že vyšší náklady na nutriční péči se vrací v úsporách nákladů na ostatní léčbu při nižším výskytu komplikací a zkrácení doby hospitalizace. Pokud je malnutrice při nemoci u hospitalizovaných včas rozpoznána a léčena způsobem, který odpovídá recentním odborným doporučením, lze očekávat:
- vzestup nákladů na diagnostiku malnutrice a nutriční péči;
- díky lepší léčbě malnutrice zlepšení klinických výstupů a zejména snížení výskytu závažných komplikací spolu s úsporami léčebných nákladů, které významně převyšují dodatečné náklady na nutriční péči.
Důkazy o prospěšnosti a nákladové efektivitě systematického vyhledávání a léčby malnutrice při nemoci v komunitní zdravotní péči rovněž existují. Většina studií nákladové efektivity nutriční péče v komunitní zdravotní péči začíná sledováním v den dimise domů, takže probíhá téměř výlučně u této selektované populace pacientů po předchozí hospitalizaci. Existují i studie z pobytových zařízení sociálních služeb. Navzdory metodologickým rozdílům mezi studiemi lze z jejich výsledků prokázat nákladovou efektivitu nutriční péče i v ambulantní sféře. Na pozitivní bilanci nutriční péče se podílí zejména úspory za snížený výskyt komplikací a zlepšení kvality života.
Klinická výživa
Základy energetického metabolismu ve zdraví a nemoci, malnutrice a katabolický stav
Spotřeba energie je základním předpokladem existence živých organismů a souvisí se všemi metabolickými procesy. Akutní a chronické onemocnění ovlivňuje energetický metabolismus v pozitivním i negativním smyslu.
Celkový energetický výdej (total energy expenditure – TEE) má dvě základní složky:
- Klidový energetický výdej (resting energy expenditure – REE) se měří za klidových podmínek po 10 hodinách hladovění a je podmíněn zejména transportními membránovými procesy, syntézou a rozkladem bílkovin, přeměnou energetických substrátů, činností srdce, dýchacího svalstva a hladké svaloviny a probíhajícími zánětlivými reakcemi a imunitními procesy.
- Energetický výdej související s fyzickou aktivitou (activity related energy expenditure – AEE) je závislý na výši fyzické aktivity. Pokud hodnotu REE měříme nebo ji odhadujeme na základě doporučených vzorců, bude celkový energetický výdej za běžných podmínek asi 1,6× vyšší než REE, což je ovlivněno především tělesnou aktivitou.
- Hodnotu klidového energetického výdeje lze měřit pomocí indirektní kalorimetrie, k odhadu lze použít i některé výpočty, např. podle Harrise a Bennedicta:
Muži [kcal/24 hodin]. BEE = 660,4730 + 13,7516 × W + 5,0033 × H − 6,7550 × A
Ženy [kcal/24 hodin]. BEE = 655,0955 + 9,5634 × W + 1,8496 × H − 4,6756 × A
Pro odhad energetické potřeby u mobilních pacientů se pro klinickou praxi v současných doporučených postupech uvádí hodnota 20–30 kcal/kg ideální tělesné hmotnosti.
Vliv nestresového hladovění na energetický metabolismus
Vzhledem k epizodickému příjmu potravy u člověka během evoluce je zřejmé, že adaptace na hladovění je dokonalá. Během hladovění jsou v první fázi spotřebovány zásoby glykogenu (během 12–24 hodin v závislosti na fyzické aktivitě). Poté se postupně energetický metabolismus orientuje na oxidaci tuků. Zvýšené uvolňování mastných kyselin je následováno zvýšenou produkcí ketolátek, které jsou pak využívány řadou tkání, především tkání nervovou.
Během dlouhodobého hladovění se postupně snižuje oxidace tělesných bílkovin. U zdravého jedince dochází k maximální adaptaci na hladovění zpravidla za 7 dní. Adaptace je zprostředkovaná hormonálními změnami (pokles hladiny inzulinu, trijodtyroninu) a poklesem celkového energetického výdeje. Oxidace bílkovin se může snížit až na 20 g denně a převážná část energetického výdeje je hrazena tukovými zásobami. Zdravý jedinec tak za předpokladu hrazení potřeb vody a elektrolytů může přežít asi 70 dní úplného hladovění. Během realimentace po hladovění po dobu několika hodin stále přetrvává oxidace tuků navzdory příjmu sacharidů. Během této doby zřejmě dochází k doplnění zásob fosforizovaných energetických metabolitů a glykogenu a tato fáze je spojena s poklesem koncentrace draslíku, fosforu a thiaminu v plazmě (realimentační syndrom).
Vliv stresové reakce na energetický metabolismus
Během akutního onemocněni (zánětlivé reakce) se energetický metabolismus podstatně mění. Především se mění hormonální ladění organismu, které charakterizuje vzestup koncentrace glukagonu a katecholaminů a přechodný pokles hladiny inzulinu. Současně se zvyšuje koncentrace kortizolu a přechodně se zvyšuje koncentrace růstového hormonu. Tato reakce je indukována zvýšenou zánětlivou aktivitou a jejím smyslem je bezprostřední reakce na stres. V této době dochází k přesunu energetických, metabolických a stavebních substrátů do míst, kde jsou potřebné: zejména jde o mobilizaci aminokyselin ze svalové tkáně do jater a do tkání postižených zánětem. V hepatocytech jsou využívány k syntéze proteinů potřebných pro průběh zánětlivé reakce (reaktanty akutní fáze, fibrinogen, albumin). V zánětlivé tkáni, slezině a ostatních orgánech jsou aminokyseliny využívány k syntéze proteinů nutných pro průběh zánětlivého procesu.
Nedílnou součástí reakce na trauma a stres je inzulinová rezistence. V kontextu dynamického procesu kritického stavu především redukuje vstup glukózy do kosterního svalstva a tukové tkáně, čímž je zajištěn přísun glukózy do tkání, které jsou na glukóze závislé (mozek, zánětlivé tkáně) a zvyšuje se produkce glukózy v játrech. To vede k lepšímu zpracovaní metabolitů glukózy (laktát a alanin). Snižuje se oxidace glukózy, která je preferenčně využívána v procesech potřebných pro tvorbu nukleových kyselin a redukčních ekvivalentů v pentózovém cyklu.
Dlouhé trvání stresové reakce má však pro organismus sebezničující důsledky: rychlý úbytek svalové hmoty má za následek ztrátu svalové funkce a postupně snižuje schopnost k zotavení. Zpětný nárůst kosterní svaloviny je pomalý a vyžaduje systematickou rehabilitační péči. Z toho vyplývá i nutnost intenzivní nutriční terapie po stabilizaci časné fáze kritického stavu a spolu s časnou rehabilitační léčbou a současně se systémovou zánětlivou odpovědí rozvíjí i antiinflamatorní reakce, jež mají za následek snížení imunokompetence a urychlení metabolických cyklů s přesunem mastných kyseliny a ukládaním tuku do svalové tkáně. Tento stav označujeme jako perzistující inflamatorní katabolický syndrom (PICS).
Makronutrienty
Základním zdrojem energie pro lidský organismus jsou tři druhy energetických substrátů: sacharidy, tuky a bílkoviny, z nichž každý má specifickou úlohu. Za normálních okolností jsou energetické substráty přijímány v potravě, v organismu jsou oxidovány za vzniku energie, anebo v různé míře ukládány do tělesných zásob. Během umělé nutriční podpory jsou aplikovány buď do střeva, nebo přímo do cévního řečiště.
Sacharidy
Sacharidy (cukry, karbohydráty, glycidy) je možné rozdělit do tří základních skupin: polysacharidy, disacharidy a monosacharidy. Polysacharidy tvoří převážnou část přijatých cukrů v běžné stravě. Pro výživu je významný škrob a maltodextrin, které jsou v gastrointestinálním traktu štěpeny na glukózu. Disacharidy jsou reprezentovány zejména sacharózou, maltózou a laktózou, které jsou ve střevě štěpeny na glukózu, galaktózu a fruktózu. Monosacharidy zahrnují glukózu a fruktózu. Glukóza se ukládá v játrech ve formě glykogenu, část je přímo utilizována periferními tkáněmi buď jako zdroj energie, nebo jako substrát pro ostatní metabolické procesy. Glukózu mohou utilizovat všechny buňky v organismu. Oxidací 1 g glukózy organismus získá energii 4 kcal, oxidací jednoho molu glukózy na vodu a oxid uhličitý tak vznikne 36 molů adenosintrifosfátu (ATP) a 2 moly guanosintrifosfátu (GTP). Za nepřítomnosti kyslíku však toto množství glukózy poskytuje pouze 2 moly ATP a 2 moly kyseliny mléčné. Přestože za anaerobních podmínek vznikne podstatně méně energie, je anaerobní metabolismus glukózy pro organismus významný, protože glukóza je jediným energetickým substrátem, který poskytuje energii i v nepřítomnosti kyslíku. V organismu je glukóza skladována jako glykogen v játrech a ve svalových buňkách. Glukóza je také potřebná pro syntézu řady metabolitů Krebsova cyklu a následně i mnoha aminokyselin (včetně glutaminu) a jiných metabolitů. Další metabolickou cestou glukózy je pentózový cyklus, který slouží ke tvorbě redukovaného nikotinamid adenin dinukleotid fosfátu (NADPH) a pentóz potřebných pro syntézu nukleových kyselin.
Tuky
Tuky (lipidy) jsou zdrojem energie (obvykle 30–40 % celkové energie) a tvoří strukturální složku buněčných membrán. Mastné kyseliny také slouží jako prekurzory eikosanoidů a dalších metabolicky aktivních derivátů. Jako energetický substrát jsou využívány především triglyceridy (estery glycerolu s mastnými kyselinami). Obsah energie v 1 g tuku je 9 kcal. Triacylglyceroly jsou postupně rozkládány v gastrointestinálním traktu na mastné kyseliny, monoacylglycerol a glycerol, jež jsou resorbovány buňkami střevní sliznice. Uvnitř buněk jsou mastné kyseliny opět reesterifikovány na triglyceridy; malé triglyceridové partikule jsou pokryty vrstvou fosfolipidů a apoproteinů a ve formě chylomikronů transportovány do lymfy a krevního oběhu.
Tuky jsou základním zásobním energetickým substrátem. Po požití smíšené potravy jsou preferenčně ukládány do tukové tkáně, zatímco glukóza je oxidována. Mastné kyseliny jsou konstantně uvolňovány z tukové tkáně do krevního oběhu, kde jsou vázány na albumin. Tento proces se zrychluje během hladovění a zejména během kritického stavu, kdy je lipolýza stimulována katecholaminy a glukokortikoidy a kdy se snižuje inhibiční vliv inzulinu. V přítomnosti kyslíku jsou mastné kyseliny oxidovány ve většině tkání s výjimkou tkání, ve kterých je kyslíku nedostatek, nebo tkání, které nemají vyvinutý oxidativní metabolismus (krevní buňky).
Mastné kyseliny nemohou utilizovat ani nervové buňky v centrálním nervovém systému, kam mastné kyseliny nepronikají vzhledem k vazbě na albumin. Pokud hladovění trvá déle, z mastných kyselin vznikají v játrech ketolátky, které mohou být v přítomnosti kyslíku oxidovány téměř všemi buňkami včetně centrálního nervového systému. Uvolňování mastných kyselin z tukové tkáně převyšuje rychlost jejich oxidace. Neoxidované mastné kyseliny jsou pak zpětně reesterifikovány jak v játrech, tak i v ostatních tkáních (sval a snad zánětlivá tkáň). Zatímco z jater mohou být transportovány zpět do tukové tkáně ve formě lipoproteinů, ve svalech zůstávají jako zdroj energie a jsou oxidovány při tělesné námaze.
Během parenterální výživy jsou tuky podávány formou tukových emulzí tvořených malými sférickými částicemi hydrofobních triglyceridů obalených vrstvou fosfolipidů. Po infuzi do krevního oběhu je jejich metabolismus podobný metabolismu chylomikronů. Maximální rychlost oxidace lipidů lze stanovit pouze během dlouhodobého hladovění. V tom případě jejich oxidace pokrývá asi 85 % energetických nároků. Odhaduje se, že maximální oxidace tuku může dosáhnout 1,5–1,7 mg/kg/min. Během kritického stavu klesá tvorba ketolátek a část energie se získává oxidací ostatních energetických substrátů, zejména aminokyselin. Maximální oxidace tuků se tak snižuje asi na 0,8 mg/kg/min. Pokud se však i během kritického stavu podává spolu s tukovou emulzí glukóza, její oxidace se dále výrazně snižuje.
Bílkoviny
Bílkoviny (proteiny) jsou hlavní strukturální složkou organismu pro buněčná těla, svalová vlákna, transportní, koagulační a onkotické komponenty plazmy, enzymy, hormony a kostní matrice.
Proteiny přijaté ve stravě jsou ve střevě štěpeny na jednotlivé aminokyseliny, které jsou resorbovány do jater cestou portálního řečiště. Během parenterální výživy jsou podávány jako směs aminokyselin přímo do krevního řečiště. Oxidaci 1 g bílkovin vzniká energie v množství 4 kcal. V běžné stravě tvoří bílkoviny asi 15 % energetického přijmu; toto množství je schopno nahradit ztrátu bílkovin vzniklou během standardních katabolických reakcí. Na rozdíl od tuků nejsou bílkoviny v organismu skladovány v zásobní formě, a katabolismus bílkovin je tak spojen vždy se ztrátou funkce.
Největší množství bílkovin se nachází ve svalové tkáni; kromě výživy je toto množství závislé na fyzické aktivitě. Rozpad a oxidace svalových bílkovin v průběhu zánětlivé reakce a fyzické inaktivity jsou tak vždy spojeny se ztrátou svalové funkce. Během dlouhodobého nestresového hladovění se ztráta svalových bílkovin snižuje vlivem adaptační reakce, v kritickém stavu se však proteiny rozpadají ve zvýšené míře. Obsah bílkovin v těle je kritický pro přežiti akutního onemocnění. Z 20 aminokyselin je 8 považováno u člověka za esenciální (isoleucin, leucin, lysin, methionin, fenylalanin, threonin, tryptofan a valin). Aminokyseliny jsou strukturální součásti proteinů, slouží jako energetický substrát a účastní se syntézy dusíkatých látek. Denně je za normálních podmínek syntetizováno v těle několik desítek gramů bílkovin, jednotlivé proteiny mají různý biologický poločas.
Celkový metabolismus bílkovin (1 g bílkovinného dusíku = 6,25 g bílkovin) v těle lze charakterizovat pomocí dusíkové bilance (rozdíl příjmu dusíku a celkových ztrát dusíku do moči, stolice a kůže). Za normální situace jsou tzv. extrarenální ztráty dusíku okolo 2 g/den. Při těžkých katabolických stavech (sepse, polytrauma, popáleniny) mohou ztráty dusíku dosáhnout i více než 50 g/den. V těchto případech nelze dosáhnout vyrovnané dusíkové bilance a cílem umělé výživy je pouze zmírnit katabolismus svalových bílkovin.
Mikronutrienty
Vitaminy a stopové prvky lidský organismus nedokáže syntetizovat. Přes jejich malou potřebu se při jejich nedostatku vyvíjejí specifické klinické symptomy, které jsou reverzibilní s úpravou zásob.
Hlavní funkce mikronutrientů jsou katalytické a antioxidační.
Vitaminy rozpustné v tucích (vitamin A, D, E, K)
Vitamin A (retinol) je prekurzorem karotenoidů důležitých pro růst buněk a udržení funkce a struktury epitelu. Nedostatek se projevuje poruchami vizu (Bitotovy skvrny) a keratinizací epitelu. Předávkování vitaminu A je spojeno s toxicitou (hepatotoxicita, alopecie, bolesti svalů).
Vitamin D (D2 ergokalciferol, D3 cholekalciferol) je řazen jednak mezi vitaminy rozpustné v tucích, ale v současné době podle struktury i množství funkcí ovlivňujících v těle i mezi hormony steroidní povahy. Je přijímán v potravě (fytosteroly) nebo vzniká v kůži účinkem ultrafialového záření. Obě formy vitaminu D2 i D3 jsou neaktivní a vyžadují dvoustupňovou aktivaci hydroxylací v játrech, ledvinách a periferních tkáních. Kromě významné funkce na mineralizaci kostí, metabolismus vápníku a fosforu jsou prokazovány další četné funkce zasahující prakticky do všech metabolických drah. Nedostatek vitaminu D má systémové účinky a nepříznivě ovlivňuje např. rozvoj aterosklerózy a kardiovaskulárních a cerebrovaskulárních onemocnění a ovlivňuje imunitní funkce.
Vitamin E (tokoferol) inhibuje lipoperoxidaci a závislost na přítomnosti selenu a kyselině askorbové vykazuje antioxidační účinky. Deficit je nejčastěji vyvolán poruchou metabolizace lipidů.
Vitamin K (K3 menachinon) je syntetizován střevní mikroflórou. Deficit se manifestuje krvácivou diatézou (koagulační faktory II, VII, IX, X a protein C, S). Kumarinové preparáty působí jako jeho antagonista.
Vitaminy rozpustné ve vodě
Vitamin C (kyselina askorbová) plní funkci antioxidantu a uplatňuje se při syntéze kolagenu, karnitinu, neurotransmiterů. Potencuje vstřebávání železa ze střeva. Lehká hypovitaminóza se projeví slabostí, únavností, anorexií a četnějšími infekty. Těžký deficit působí skorbut s projevy krvácení z dásní, petechiemi a zhoršením hojení ran. Zvýšená potřeba je v těhotenství, laktaci a u kriticky nemocných.
Vitamin B1 (thiamin) je kofaktorem dekarboxylázy mastných kyselin a má zásadní roli pro trofiku periferních nervů. Dlouhodobý nedostatek se manifestuje postižením periferních nervů dolních končetin (suchá forma beri-beri), resp. srdečním selháním, dušností, hepatomegalií (vlhká forma beri-beri). U alkoholiků vzniká deficit rychle (Wernickeho encefalopatie). Potřeba suplementace je zásadní po zahájení výživy u těžkého katabolického stavu s rozvojem realimentačního syndromu a v léčbě těžké diabetické ketoacidózy.
Vitamin B2 (riboflavin) je důležitý pro průběh oxidoredukčních reakcí. Deficit má projevy obdobné celé skupině vitaminu B s postižením orální sliznice (stomatitida, glositida) a keratitidou.
Vitamin B6 (pyridoxin) je součástí kofaktorů enzymů participujících na metabolismu proteinů (transaminační reakce), lipidů, steroidů a procesu glukoneogeneze.
Vitamin B12 (methylkobalamin) má důležitou úlohu při syntéze neurotransmiterů, myelinu a erytrocytů. Deficit má projevy neurologické a hematologické (megaloblastová anémie). Deficit je vzhledem k resorpční lokalizaci v oblasti terminálního ilea u nemocných po resekci ileocekální oblasti, nespecifických střevních zánětů a alkoholiků, u nichž je častý současný deficit folátu.
Stopové prvky
Selen je součástí glutathionperoxidázy. V součinnosti s vitaminy C, E a zinkem je svým antioxidačním účinkem hlavním faktorem enzymatické obrany. Selenoproteiny mechanismem redukce lipoperoxidů a peroxidu vodíku na vodu brání citlivé struktury buněk před oxidativním postižením. Selen je po vstřebání tenkým střevem transportován v plazmě ve formě selenoproteinu P. Jeho hladina ve stresu fyzickém i psychickém výrazně klesá. Deficit se klinicky projeví jako anémie, arytmie, svalová slabost a bolest, kardiomyopatie.
Železo je zapojeno do metabolických funkcí k přenosu kyslíku. Dvojmocné železo je z 60 % navázáno v hemu (hemoglobin obsahuje 4 hemové jednotky s navázanými 4 molekulami kyslíku, v myoglobinu je pouze 1 hemová jednotka s navázanou 1 molekulou kyslíku). Železo je součástí i dalších metaloenzymů nehemového charakteru. Jde o cytochromy mitochondrií podílejících se na uvolňování energie v Krebsově cyklu a endoplazmatickém retikulu (cytochrom P450), které se účastní detoxikace léků, kancerogenů, syntézy kolagenu, PUFA, neurotransmiterů (serotonin, dopamin, noradrenalin). Při akutním onemocnění (zánět, malnutrice, toxické postižení, šok) není sliznice střeva schopna v dostatečném množství vstřebávat železo. Také vazebná schopnost je menší, během několika málo hodin po traumatu (stresu) klesá plazmatická forma železa (transferin) a stoupá jeho zásobní forma (feritin). Klesá tak využitelnost železa pro bakterie, které železo potřebují pro svůj růst a množení. Železo se nemá z tohoto důvodu substituovat v akutní fázi onemocnění, také jako reaktivní kov v akutních stavech vede ke tvorbě OH radikálů (Fentonova reakce).
Zinek je součástí metaloenzymů a uplatňuje se při syntéze inzulinu, v imunitních reakcích a při hojení ran. Deficit způsobuje zvýšenou vnímavost k infekcím, zhoršené hojení ran, poruchu glukózové tolerance, stomatitidy a glositidy.
Měď má četné funkce související s absorpcí a využitím železa při syntéze erytrocytů. Je součástí superoxiddismutázy. 60–90 % množství mědi je vázáno na ceruloplasmin. Deficit mědi se manifestuje anémií, leukopenií, osteoporózou a kardiálními poruchami. Toxicita je způsobena cholestázou (hepatocelulární postižení, Wilsonova choroba). Absorpce mědi a zinku se děje přes společný přenašeč: nadměrná suplementace zinku, který obsadí jeho vazebnou kapacitu, brání vstřebávání mědi s rozvojem anémie rezistentní na přívod železa a kyseliny listové.
Chrom ovlivňuje metabolismus hlavních energetických substrátů, především sacharidů. Zajišťuje vazbu inzulinu na inzulinové receptory. Nedostatek vede k inzulinové rezistenci.
Projevem toxicity při předávkování jsou dermatitidy.
Mangan je kofaktorem mnoha metaloenzymů. Ovlivňuje metabolismus sacharidů, cholesterolu a mastných kyselin. Jeho předávkování bývá spojeno s dlouhodobou parenterální výživou.
Elektrolyty a acidobazická rovnováha. Tekutinová terapie.
Metody nutriční intervence
Nutriční zajištění v nemocnici a ambulantní péči. Dietní systém.
Klinická výživa je nutriční podpora v rámci zdravotní péče. Jejím cílem je podpořit organismus během léčby nebo při prevenci rozvoje onemocnění. Doporučený postup pro realimentaci hospitalizovaných a ambulantních pacientů je uveden v Metodickém doporučení Ministerstva zdravotnictví pro nemocniční stravování (Věstník MZ ČR č. 10, 2020).
Běžná strava je definována jako jídlo, které jedinec obvykle konzumuje ve svém vlastním prostředí.
Dieta je řízený příjem pokrmů a tekutin za účelem dosažení specifického cíle. Cílem diet ve zdravotnických zařízeních je udržet nebo zlepšit zdravotní stav, případně se využívají k diagnostickým účelům. Diety jsou charakterizovány podle obsahu energie a zastoupení jednotlivých živin, způsobu přípravy stravy, případně jejich fyzikálních vlastností (denzita, velikost kousků atd.).
Dietní systém se skládá z diet základních a speciálních. Základní diety jsou určeny pro pacienty bez medicínsky odůvodněných speciálních dietních potřeb. Speciální diety a dietní postupy jsou určeny pro pacienty se specifickými nutričními potřebami z medicínské indikace. Některé diety se mohou vzájemně kombinovat.
Plnohodnotné diety mají kompletní složení nutrientů. Dieta 3FIT (dieta základní ve zdraví) se využívá u pacientů, kteří nemají dietní omezení a jsou bez nutričního rizika. Dieta 3MAL s vyšším obsahem energie i bílkovin pro nemocné v riziku malnutrice je přizpůsobena pacientům s potřebou realimentace v průběhu akutních a chronických onemocnění, kteří trpí nedostatečnou chutí k jídlu, aby se co nejvíce snížilo riziko vzniku nebo progrese malnutrice.
Speciální diety jsou indikovány podle charakteru onemocnění pacienta: D2 šetřící, D9 diabetická s denním obsahem sacharidů 120 g, 150 g, 200 g, 250 g a 300 g, dieta dysfagická s upravenou strukturou stravy (tekutá, kašovitá, mletá), diety při potravinových alergiích (bezlepková, nízkolaktózová), dieta výživná, dieta redukční, dieta vysoko- a nízkoproteinová a další. Pro pacienta se specifickými potřebami se vytváří individuální nutriční plán.
Neplnohodnotné diety jsou deficitní z hlediska některých složek potravy a jejich používání musí být časově omezeno.
Důležitou složkou nutriční péče pro hospitalizované pacienty je i pitný režim.
Výživa ve vlastním sociálním prostředí
Ambulantní výživa představuje většinou pokračování nutriční intervence zavedené během hospitalizace do domácího prostředí pacienta. Vychází z charakteru základního a konkomitantních onemocnění, dlouhodobé prognózy, kvality života, sociálního zázemí a etických aspektů. V domácím prostředí může být poskytována dietní strava, výživa obohacená orálními nutričními suplementy, enterální výživa a parenterální výživa. Ambulantní enterální a parenterální výživa spadá do kompetence nutricionisty a pacient je sledován v nutriční ambulanci příslušného zdravotního zařízení.
Enterální výživa
Enterální výživou se v širším slova smyslu rozumí podávaní farmaceuticky připravených výživných roztoků do trávicího traktu, nikoliv podávaní kuchyňsky upravených diet, mixovaných, tekutých či blenderizovaných diet. Kromě dodávky živin v množství potřebném pro další existenci a vývoj pacienta má enterální výživa další pozitivní účinky: udržení střevní bariéry, prevenci bakteriální translokace, prokrvení splanchnické oblasti a výživu střevních buněk. Enterální farmakoterapií se rozumí podávaní farmaceutických přípravků do tenkého střeva.
Indikace enterální výživy
Enterální výživa (EV) je metodou první volby u pacientů ve stavu malnutrice nebo riziku jejího vzniku při předpokladu zachované funkce trávicího traktu. Pokud pacienti, především v kritickém stavu, enterální výživu netolerují, není nutné se snažit za každou cenu dosáhnout dodání plného příjmu energie a makro- i mikronutrientů enterální výživou a parenterální i enterální výživu lze s úspěchem kombinovat a chybějící nutrienty dodat parenterálně.
Kontraindikace enterální výživy
Rozdělujeme je na absolutní a relativní. Absolutní kontraindikací jsou náhlé příhody břišní (perforační, zánětlivé nebo obstrukční), krvácení do gastrointestinálního traktu, akutní selhání střeva s profuzními průjmy a časná fáze šokového stavu, kdy je kontraindikovaná jakákoliv forma výživy. K relativním kontraindikacím počítáme paralytický ileus, těžké zánětlivé či postradiační poškození tenkého střeva, případně opakované zvracení, kdy je možné podávat enterální výživu pouze v minimálním množství, které slouží k výživě enterocytů, a to za Treitzovu řasu. Enterální výživu většinou nepodáváme u pacientů s enterokutánními píštělemi s vysokou sekrecí, pokud se nepodaří zavést konec nutriční sondy za ústí píštěle. Za kontraindikaci podávaní jakékoliv artificiální výživy se považují i etické aspekty v případech, kdy výživa pacientovi v terminální fázi onemocnění již nemůže přinést jakýkoliv benefit.
Přístupy pro enterální výživu
Enterální výživu je možné podávat perorálně, cestou nazogastrické nebo nazojejunální sondy, punkční endoskopické gastro- či jejunostomie, případně chirurgické jejunostomie. Nejjednodušší cestou podávaní výživy je sipping (popíjení či srkání orálních nutričních suplement – ONS), který je většinou indikován jako doplňková enterální výživa. Nazogastrická sonda (NGS) je indikována pro krátkodobou aplikaci enterální výživy, při které nehrozí aspirace, často na resuscitačních či chirurgických odděleních. Nazojejunální sonda (NJS) je zaváděna u pacientů s indikací plné či doplňkové enterální výživy u pacientů s hrozící aspirací a je využívána i v domácím prostředí (nejčastěji u pacientů s Crohnovou chorobou, akutní či chronickou pankreatitidou, v přípravě před operací apod.). Zavádí se endoskopicky, možné je i spontánní zaplavání sondy za Treitzovu řasu do 2.–3. jejunální kličky.
Punkční endoskopická gastrostomie je indikována při předpokladu dlouhodobého či trvalého podávaní enterální výživy, např. při dysfagii s rizikem aspirace nebo existující či předpokládané neprůchodnosti horní časti trávicí trubice, např. během radioterapie pro tumory hlavy a krku. Zavádí se punkcí břišní stěny metodou push či pull za endoskopické kontroly. Variantou PEG je výživový knoflík (feeding button – FB) s externím vyústěním v úrovni kůže.
Enterální výživu můžeme podávat buď bolusově (do žaludku), nebo kontinuálně (při podávaní do žaludku nebo tenkého střeva), většinou pomocí peristaltické pumpy. Velikost bolusů se pohybuje podle snášenlivosti pacienta většinou mezi 250 a 350 ml aplikovaných 5–8× denně, rychlost aplikace enterální výživy při kontinuálním podávání je většinou 100–120 ml/h. V domácích podmínkách je vhodná noční aplikace s přestávkou 6–8 hodin.
Komponenty enterální výživy
Přípravky pro enterální výživu se rozděluji na polymerní (vysokomolekulární, případně nutričně definované formule či formule s definovaným složením živin) a oligomerní (nízkomolekulární, případně chemicky definované diety). Variantou polymerních přípravků jsou modifikované přípravky pro různé speciální situace a orální nutriční suplementa užívaná pro sipping. Rozdělení podle obsahu živin je na izo- a hyperkalorické a vysokoproteinové. Aplikace mixované či tekuté diety do sondy či gastrostomie není postupem lege artis.
Polymerní enterální výživa obsahuje jednotlivé živiny většinou v původní formě (intaktní proteiny, polysacharidy, tuk ve formě triglyceridů s dlouhými řetězci). Obsah nebílkovinné energie je rozdělen mezi tuky a sacharidy v poměru 40 % tuku (35–60 %) a 60 % sacharidů (40–65 %). Přípravky jsou nejčastěji izokalorické (1 kcal v 1 ml přípravku), využívají se i varianty hyperkalorické a s navýšením obsahu proteinu. Většina přípravků obsahuje vlákninu (jedno- či vícedruhovou), která snižuje riziko gastrointestinálních komplikací. Tyto přípravky obsahují v množství odpovídajícím 1 500 kcal vitaminy, minerály a stopové prvky odpovídající denní doporučené dávce (DDD) podle výživových doporučení. Ve většině případů tyto přípravky neobsahují laktózu, puriny a lepek, lze je tedy podávat i pacientům s laktózovou intolerancí, celiakií či dnou. Osmolarita těchto přípravků bývá nižší než 400 mosm/l. Polymerní výživu lze podávat do žaludku, ale i do duodena či jejuna.
Oligomerní formule jsou nízkomolekulární, nevyžadují tedy štěpení enzymy trávicího traktu a ke své resorpci potřebují menší množství energie než polymerní diety. Obsahují aminokyseliny či oligopeptidy (di-, tripeptidy), disacharidy a MCT oleje, jejichž stravitelnost je lepší než stravitelnost LCT tuků, a neobsahují balastní látky (vlákninu). Jejich nevýhodou je většinou vyšší osmolarita.
Komplikace enterální výživy
Komplikace enterální výživy nejsou (kromě aspiračních příhod) tak závažné jako komplikace parenterální výživy. Komplikace enterální výživy jsou gastrointestinální, infekční, metabolické a mechanické. Gastrointestinální komplikace zahrnují průjem, obstipaci, nauzeu, anorexii, nadýmání, bolesti břicha, zvracení, reflux a aspiraci. Infekční komplikace zahrnují infekční průjem, aspirační pneumonii (nejčastěji pravostrannou), sinusitidy a lokální infekci vstupu PEG. Mechanické komplikace zahrnují vytažení či obturaci sondy či PEG, vředové léze v průběhu sondy, vřed pod diskem PEG či burried bumper syndrom. K metabolickým komplikacím, které jsou významně méně časté než u parenterální výživy, řadíme hyperhydrataci a dehydrataci, minerálové dysbalance a dumping syndrom.
Parenterální výživa
Parenterální výživa je rezervovaná pro stavy, kdy enterální výživa je kontraindikována, není tolerovaná nebo nepokrývá kompletní nutriční nároky. Při její ordinaci se vychází z tekutinové bilance, klinického stavu, délky trvání a cesty aplikace. Kompozice PV je určena množstvím jednotlivých makronutrientů, potřebou vody, iontů, stopových prvků a vitaminů.
PV se dělí podle místa podání do žilního systému na centrální a periferní. Dále se podle režimu podání rozlišuje na kontinuální a cyklickou. Jiným způsobem je dělení podle systému přípravy a podání jednotlivých složek. Dříve používaný tzv. systém multi-bottle byl prakticky překonán a v současnosti zcela převažuje systém vaků all-in-one (AIO), které jsou lékárensky nebo industriálně připravované. Objem vaků je zpravidla 650–2 200 ml. U lékárensky připravovaných vaků je nezbytností laminární box v místnosti se zvláštním režimem, jednotlivé komponenty s ověřenou kompatibilitou se míchají v určeném pořadí.
Přístupy pro parenterální výživu
Periferní přístup je vhodný pro krátkodobou a spíše doplňkovou parenterální výživu. Je preferován zejména u pacientů, u kterých chceme odbourat rizika spojená s kanylací centrálního žilního systému nebo kdy tato kanylace není možná. Podmínkou je přístupná periferní žíla, do které dodáváme infuzní směs s osmolalitou < 900 mmol/kg. Pro účely periferní parenterální výživy zavádíme nejlépe zvláštní kanylu na předloktí. Prevencí flebitidy je relativně nižší osmolalita infuzní směsi, malý průměr kanyly, přísná asepse při zavádění a častá preventivní výměna kanyl. Důležité je vyvarovat se útisku zakalované žíly převazovým materiálem, protože snížení průtoku krve okolo kanyly zvyšuje riziko rozvoje zánětu.
Centrální žilní přístup pro parenterální výživu umožňuje dlouhodobé podávání koncentrovaných roztoků. Riziko rozvoje flebitidy a trombózy je zde významně nižší. Druh katétru a místo zavedení se volí podle předpokládané délky parenterální výživy a potřeby dalších nitrožilních intervencí. Kanylace centrální žíly se provádí punkční technikou. Katétry jsou zaváděny elektivně za přísných podmínek asepse a pod ultrazvukovou kontrolou navádění. Nejčastěji používaným přístupem je v. subclavia následovaná v. jugularis interna. Přístup do podklíčkové žíly má výhodu ve snadnějším ošetřování a nižším výskytu katétrových infekcí. Z obdobných důvodů jsou preferovány pravostranné žíly. Jinou možností (v současné formě preferovanou) je zavedení centrálního žilního katétru formou PICC (periferně zaváděný centrální katétr), při které odpadá riziko komplikací kanylace velkých žil. Jedná se o tenké katétry zaváděné pomocí UZ navigované punkce nejčastěji do v. brachialis ve střední třetině paže.
Pro potřeby dlouhodobé (domácí) PV jsou zaváděny tunelizované centrální žilní katétry nebo implantabilní žilní porty. Tunelizované katétry jsou extraluminálně v podkožní části opatřeny manžetou, která zabraňuje prostupu infekce a dislokaci katétru. Některé typy katétrů obsahují i vnitřní chlopeň, která zabraňuje zpětnému toku krve. Implantace žilního portu probíhá obdobně s tím rozdílem, že se v podkoží vytvoří kapsa pro vlastní port. Při umístění se vždy bere v úvahu možnost ošetřování vstupu pacientem. Pro PV v trvání do několika měsíců jsou vhodné periferně zavedené centrální žilní katétry (PICC).
Životnost katétrů a množství komplikací je přímo úměrné kvalitě ošetřování. Při převazech se používá v maximální míře sterilní technika a průchodnost katétrů a portů se udržuje správným proplachováním.
Komponenty parenterální výživy
Složení parenterální výživy je dáno individuálními potřebami pacienta z hlediska objemu, energie a dusíku. Při konstrukci směsi pro periferní PV je třeba na prvním místě uvažovat osmolaritu směsi (při > 900 mosm/l hrozí rozvoj flebitidy). Osmolalita směsi se většinou snižuje díky vyššímu podílu energie v tucích (až 50 %) a v případě potřeby lze směs ředit sterilní vodou. Takto lze dodat 1 300–1 700 kcal energie a 10–15 g dusíku za cenu vyššího objemu. U centrální PV tato omezení odpadají a hlavním omezením je nutnost prevence metabolických komplikací.
Glukóza je jediným sacharidem, který je používán v rámci PV. Denní dávka je 3–5 g/kg/den (50–60 % celkové energie). Již minimální dávka sacharidů příznivě ovlivňuje metabolismus snížením lipolýzy tukové tkáně a ketogeneze, čímž se snižuje katabolismus proteinů. Při kontinuálním přívodu vyšším než 5 mg/kg/min významně stoupá spotřeba kyslíku a produkce CO2, což může teoreticky způsobit zhoršení respirační insuficience. Nadměrný přívod sacharidů vede také k hyperglykemii s osmotickou diurézou a ke zvýšení syntézy triacylglycerolů v játrech s cholestázou.
Tukové emulze mají složení podobné chylomikronům s tím, že neobsahují apoproteiny a estery cholesterolu. Po jejich aplikaci však dochází k rychlé výměně apoproteinů s endogenními lipoproteinovými částicemi a další metabolismus je velice podobný chylomikronům. Moderní nutriční přípravky obsahují dostatečné množství esenciálních mastných kyselin (kyselina linolová, linolenová), jsou vyvážené z hlediska poměru n-3/n-6 polynenasycených mastných kyselin a obsahují lipidy s mastnými kyselinami s dlouhou i střední délkou řetězce (MCT/LCT). Mastné kyseliny MCT se nestávají součástí tělesných membrán a slouží výlučně jako zdroj energie. Obvyklá dávka tuků v umělé výživě je 0,7–1,2 g/kg/den a rychlost podání parenterálních tukových emulzí by neměla u směsi obsahující pouze LCT překročit 0,1 g/kg/h a 0,15 g/kg/h u směsi s MCT/LCT. Moderní tukové emulze obsahují směs LCT, MCT, omega-9 a omefa-3 mastných kyselin. Podávaní tuků je třeba monitorovat a jejich dávky upravit u pacientů s hypertriglyceridemií.
Aminokyselinové roztoky v parenterální výživě dělíme na úplné (výživné) a speciální (orgánově specifické). Komerční směsi obsahují 10–15% roztok aminokyselin. Složení úplných směsí je větším či menším kompromisem mezi cenou roztoku a optimálním složením, které by přibližně odpovídalo bílkovině lidského mléka. Doporučená denní dávka aminokyselin v PV se pohybuje v rozmezí 1–1,5 g/kg/den, resp. pro případy vysokých ztrát až 2,0 g/kg/den.
Mikronutrienty – stopové prvky a vitaminy – patří mezi esenciální součásti výživy. Jsou potřebné v relativně malých množstvích. Doporučené denní substituční dávky stopových prvků a vitaminů obsahuje většina substitučních preparátů. Karenční stav se většinou rozvíjí v delším časovém období až po vyčerpání vnitřních zásob, a proto se nejčastěji manifestuje u pacientů s chronickou podvýživou nebo při nedostatečné suplementaci v rámci dlouhodobé umělé výživy. Karenční stav se nejprve projevuje subklinicky a je prokazatelný pouze laboratorně, později se rozvíjejí typické příznaky, které tvoří součást tzv. karenčních syndromů. Karenční syndromy ustupují po dodání daného mikronutrientu. Potřeba vitaminů a stopových prvků stoupá ve stresových situacích a potom v průběhu rekonvalescence a hojení. V těchto situacích se nelze řídit doporučenými substitučními dávkami pro zdravou populaci. Mikronutrienty se vzhledem ke své chemické reaktivitě dodávají do vaku parenterální výživy až 1–3 hodiny před jeho vykapáním.
Komplikace parenterální výživy jsou nejčastěji metabolického původu a spojené se zabezpečením venózního přístupu.
Komplikace přístupové cesty jsou včasné, vznikající v návaznosti na zavedeni, a pozdní, které jsou následky nevhodně zvoleného místa zavedení nebo nesprávné ošetřovatelské péče. Prevence katétrové trombózy spočívá v preventivní aplikaci nízkomolekulárního heparinu. Infekční komplikací je katétrová sepse, která nejčastěji souvisí s intraluminální infekcí katétru, vzácněji s hematogenním přenosem z jiného infekčního fokusu. Incidence katétrové sepse se významně snížila s používáním antiseptických zátek s taurolidinem.
Deficit minerálů a mikronutrientů vzniká nejčastěji časně po zahájení výživy a je způsoben realimentací (realimentační syndrom). Jinou metabolickou komplikací je hyperalimentace (overfeeding) manifestující se hyperglykemií a hypertriglyceridemií. Pozdní orgánové komplikace relativně často provázejí dlouhodobou domácí parenterální výživu ve smyslu hepatopatie po měsících až letech a kostní nemoci po letech aplikace.
Klinická výživa v různých situacích
Výživa u onkologicky nemocných
Malnutrice u onkologických onemocnění je častá, zejména v pokročilém stadiu malignity a stupeň ztráty hmotnosti koreluje s celkovým přežitím pacientů. Screening rizika vzniku a monitorování stavu výživy jsou předpokladem správného postupu při nutriční intervenci. Snížení negativních dopadů malnutrice u nádorových onemocnění je zásadním principem nutriční podpory. Nádorová kachexie je typicky provázena systémovou zánětlivou reakcí a anatomickými a funkčními poruchami. Symptomy omezující příjem potravy jsou chronická bolest, nevolnost, zvracení, průjmy, obstipace, dušnost a jiné příčiny dané komplikacemi nádorového onemocnění nebo vedlejšími účinky protinádorové terapie.
U pacientů se ztrátou hmotnosti jsou nutriční sledování a následná intervence indikovány od prvních symptomů maligního onemocnění, neboť je předpoklad prohlubování malnutrice s postupujícím stavem a během terapie. Tvrzení, že výživou podporujeme růst nádoru, je naprostý omyl. Pokud je zachována funkce trávicího traktu, lze začít s nutriční podporou proteinovými přídavky a orálními nutričními suplementy. V případech lokalizace nádorového procesu v orofaciální oblasti nebo jícnu je třeba anticipovat očekávanou poruchu polykání během terapie a předem zajistit vstup do horní části trávicího traktu, nejčastěji pomocí PEG.
Více informací o nutriční podpoře onkologicky nemocných najdete zde 31. INDIKACE NUTRIČNÍ PODPORY ONKOLOGICKY NEMOCNÝCH » Linkos.cz a zde Pracovní skupina nutriční péče v onkologii při ČOS » Linkos.cz
SHRNUTÍ – Výživa u onkologicky nemocných
-
- malnutrice zhoršuje prognózu. Předvídej, eliminuj rizika;
- začni včas s nutriční podporou, spolupracuj s rodinou.
- připrav se na komplikace léčby.
- v paliativní péči zvaž reálný benefit výživy a stanov si podmínky ukončení nutriční podpory.
Užitečné informace pro vaše pacienty najdete zde.
Nutriční podpora u seniorů
Zatímco u mladších jedinců s dobrou funkční rezervou si můžeme dovolit během akutního onemocnění po omezenou dobu vyčkat s nutriční podporou, u akutně nemocných seniorů je třeba jednat velmi rychle. Již sám pobyt na lůžku společně se základním onemocněním vede ke ztrátě svalové hmoty a hladovění tento průběh pouze prohlubuje. Pokud chceme zabránit komplikacím spojeným s podvýživou, je třeba na ni především myslet.
U nemocných seniorů by měl byt prováděn nutriční screening vždy. Nejvhodnější je formulář MNA určený pro seniory. Tento jednoduchý test pátrá po recentním snížení příjmu stravy, poklesu hmotnosti a přibližném složení těla. U seniorů je navíc doplněn o otázky týkající se tělesné aktivity, neboť právě ta informuje o stavu kosterní svaloviny a zásobách bílkovin. Nutné je sledovat přijatou stravu. V této fázi nejde o nákladné postupy a nemocnému stačí podávat nutriční doplňky formou přídavků nebo sippingu. Neváháme však ani se včasným zahájením parenterální výživy.
SHRNUTÍ – Výživa u seniorů
-
- 30–35 kcal/kg IBW, 1,2–1,5 g/kg IBW bílkovin;
- současný zánětlivý proces významně zvyšuje mortalitu;
- zohledni komorbidity;
- podporuj fyzickou a duševní aktivitu.
Celkový denní příjem energie by měl dosahovat 30–35 kcal/kg a bílkovin 1,2–1,5 g/kg tělesné hmotnosti. Interval snížené tělesné aktivity by měl být u seniorů co nejkratší. Nutriční podpora nesmí nemocného imobilizovat; nelze ho tedy tlumit za účelem poskytování nutriční podpory. Aktivní přístup k výživě a k rehabilitaci by měl pokračovat i po překonání akutního onemocnění. Znovunabytí svalové hmoty a síly je velmi pozvolné a trvá i několik týdnů až měsíců. V této době se doporučuje plnohodnotná a vyvážená strava, kterou je možné doplnit o nutriční doplňky (ONS). Takový postup výrazně snižuje počet rehospitalizací akutně nemocných seniorů.
Užitečné informace pro vaše pacienty najdete zde.
Výživa v chirurgii
Malnutrice je u chirurgického pacienta významným negativním faktorem, který má vliv na pooperační morbiditu i letalitu. Je jevem poměrně častým zvláště u onkochirurgických pacientů, u seniorů a u pacientů s chronickým onemocněním a komorbiditami. Na vývoji malnutrice chirurgického pacienta se podílejí vlastní nemoc, omezení příjmu jídla kolem operačního výkonu, proteinový katabolismus a nechutenství v důsledku pooperační zánětové reakce. Velké operační trauma vede k přesunu tekutin mezi intravaskulárním a intersticiálním prostorem vlivem zvýšené kapilární propustnosti a spolu s případným přímým perioperačním zhmožděním střeva je příčinou intestinálního otoku. Přesun tekutin je spojen s prodloužením pooperační střevní paralýzy. Metabolická složka reakce na operační trauma spočívá ve zvýšení klidového energetického výdeje a zvýšení proteinového katabolismu. Ztráta bílkovin je nejvyšší v prvním týdnu, ale protrahovaný katabolismus spolu s malým příjmem bílkovin může vést k fatální proteinové devastaci s důsledkem úmrtí na infekční komplikace. Imunologickou složkou operačního traumatu je imunoparalýza s náchylností k infekčním komplikacím vlivem současně probíhající systémové prozánětové a protizánětové reakce.
Současná doporučení ve shodě s konceptem ERAS (Enhanced Recovery after Surgery) se vyjadřují k nutričním otázkám v perioperačním období. Pacienti před plánovaným chirurgickým výkonem, u kterého není zvýšené riziko aspirace, popíjejí čiré tekutiny do 2 hodin před anestezií a tuhou stravu mohou požít do 6 hodin před anestezií. Předoperační podávání cukerných roztoků vede ke snížení pooperační inzulinové rezistence. U většiny pacientů je vhodné zahájit perorální příjem čirými tekutinami během několika hodin po operaci a další konkrétní množství a druh diety se přizpůsobuje gastrointestinálním funkcím a individuální toleranci pacientem. Obvyklé požadavky na pokrytí energetických potřeb jsou 25–30 kcal/kg a na dodávku proteinů 1,2–1,5 g/kg ideální hmotnosti. Enterální způsob nutriční terapie by měl být vždy preferován, kromě kontraindikací daných dysfunkcí nebo komplikacemi trávicího traktu. Pokud nelze dosáhnout energetické a nutriční cíle perorálním nebo enterálním příjmem po dobu delší než 7 dní, je doporučeno kombinovat enterální výživu s parenterální.
Základem předoperačního vyšetření je zhodnocení nutričního stavu a kardiopulmonální rezervy. Rozdílný přístup k předoperační přípravě bude u pacienta v normálním nutričním stavu a u nemocného v malnutrici nebo hrozící malnutrici.
Nutričními intervencemi kolem operace jsou:
- Dlouhodobá komplexní intervence nutričně rizikových pacientů s odložitelným výkonem v podobě nutriční podpory a pohybové rehabilitace v délce minimálně 4 týdnů pro zvýšení proteinové hmoty organismu a funkční kardiopulmonální rezervy.
- Krátkodobá nutriční podpora v délce 7–14 dnů u nutričně rizikových pacientů před velkou operací (typicky pro nádor); nevede ke zvýšení proteinové hmoty organismu, ale koriguje depleci minerálů, vitaminů, stopových prvků, ovlivňuje hypometabolismus a zlepšuje pooperační reaktivitu.
- Pooperační nutriční podpora nutričně rizikových pacientů s cílem podpořit proteosyntézu a minimalizaci dlouhodobé ztráty proteinu.
- Dlouhodobé nutriční monitorování a péče, pokud u pacienta přetrvává riziko vzniku malnutrice.
SHRNUTÍ – Výživa v chirurgii
-
- zjisti stav výživy a předvídej rizika;
- preferuj orální cestu nutrice;
- nenech pacienta hladovět před operací;
- časná realimentace a mobilizace, ERAS.
Užitečné informace pro vaše pacienty najdete zde.
Výživa u kriticky nemocných
Podle současného stavu znalostí o nutriční intervenci u kritických pacientů na podkladě klinických studií, jejich metaanalýz a aktuálních doporučených postupů lze formulovat racionální východiska pro sestavování postupu výživy a rehabilitace u jednotlivého pacienta. Akutní stres vyvolává zásadní změny substrátového metabolismu, které jsou na rozdíl od prostého hladovění jen minimálně ovlivnitelné nutriční intervencí. Exogenní přívod glukózy v iniciální fázi kritického stavu nepotlačí její endogenní vznik (glukoneogenezi) v játrech a ledvinách. Přehnaná nutriční intervence v akutní fázi tedy může podporovat neúčelný hypermetabolismus (futilní cykly) a interferovat s přirozenou úklidovou reakcí – autofagií.
Pro nutriční intervenci u pacienta v šokovém stavu je nutné respektovat dynamický vývoj oběhové a metabolické odpovědi. V první časné fázi je prioritou oběhová stabilizace a energeticky je využívána glukóza z endogenních zdrojů jako základní substrát; externí přívod energie není využitelný. Druhá fáze trvající obvykle do 48 hodin je charakterizována hyperkatabolismem a je následována pozdní fází po následujících 5–7 dní. Pokud během této doby nedojde k zotavení, dochází k přechodu do PICS (perzistující zánětlivý katabolický syndrom), při němž dochází k progresivnímu úbytku svalové hmoty a často k vývoji syndromu multiorgánové dysfunkce.
Proteolýza může znamenat úbytek až 12–30 g dusíku za den (70–200 g bílkovin odpovídající 200–600 g svalové hmoty). V počáteční fázi hospitalizace na JIP je tedy nutno preferovat dostatečný přívod proteinů (1,0–1,5 g/kg IBW), který se podle současné úrovně poznání zdá být důležitější než přívod energie, především u pacientů s již existující sarkopenií. Přívod energie by měl být stanoven podle indirektní kalorimetrie. Pokud není k dispozici, počítáme s hodnotami 20–30 kcal/kg IBW. Enterální výživu zahajujeme co nejdříve po oběhové stabilizaci a navyšujeme podle tolerance. Pokud enterální výživou není dosaženo nutričního cíle mezi 3. a 7. dnem pobytu na JIP, je indikováno její doplnění suplementární parenterální výživou.
Snaha o zachování integrity střevního epitelu a tím i bariérové funkce střeva v sepsi je logickou prioritou, enterální cesta je tak přirozenou cestou přívodu energie a proteinů a je výhodné ji upřednostnit, pokud není kontraindikována. Parenterální výživa v redukované dávce je však i v časné fázi bezpečnou alternativou časné enterální výživy v případě její kontraindikace.
Zvláštní pozornost vyžadují obézní pacienti s nižším proporcionálním objemem svalové hmoty, tzv. sarkopenickou obezitou. Z nedostatečného přívodu energie a dusíku trpí nejvíce nemocní s BMI < 18 a > 35.
Suplementace iontů, stopových prvků a vitaminů je nedílnou součástí nutriční podpory. Farmakonutrice a doplňování imunoaktivních látek do parenterální a enterální výživy se rutinně nedoporučuje; specifické farmakonutrienty (glutamin, selen, mikronutrienty) jsou předmětem dalšího výzkumu: mohou prospívat některým nemocným a v různých fázích onemocnění, pro jiné však mohou mít nežádoucí efekty. Obdobně tak úroveň současného poznání nepodporuje myšlenku orgánově specifické výživy při převažujícím poškození jednoho z důležitých orgánů (játra, ledviny, plíce).
Rehabilitace je nedílnou součástí komplexní péče o kriticky nemocného, neboť přispívá k zachování svalové hmoty a síly. Je nutné ji zahájit i pasivní formou co nejdříve po přijetí nemocného na JIP.
SHRNUTÍ – Výživa kriticky nemocných
-
- výživa až po oběhové stabilizaci;
- preferuj enterální cestu;
- pozor na overfeeding;
- pozor na realimentační syndrom;
- cíl pro energii: 20–25 (30) kcal/kg IBW;
- cíl pro protein: 1,0–1,5 g/kg IBW.
Výživa při selhání střeva, syndrom krátkého střeva
Syndrom krátkého střeva (SBS) je podle etiologie heterogenní skupina stavů s podobným vyústěním do podoby intestinálního selhání různé závažnosti. Délka tenkého střeva v dospělosti je variabilní (300–850 cm), funkční absorpční plocha je kolem 300 m2. Mezi funkce tenkého střeva patří digesce, absorpce, produkce hormonů a mediátorů a bariérová a imunitní funkce (GALT). Úloha tlustého střeva je především resorpční, ale kolon může být i zdrojem příjmu energie. Mikrobiom tračníku je stabilním a individuálně specifickým ekosystémem obsahujícím až 1 000 bakteriálních kmenů a 1014–1015 bakterií.
Selhání střeva znamená snížení vstřebávací funkce GIT pod nezbytné minimum potřebné pro absorpci makronutrientů a/nebo vody a elektrolytů, vyžadující jejich parenterální suplementaci. Méně závažné stavy jsou označovány jako intestinální nedostatečnost. Funkční klasifikace selhání střeva rozeznává 3 typy: typ I je akutní a přechodné selhání střevní funkce, typ II je nejčastěji spojen s MODS a může vyústit do potřeby dlouhodobé parenterální suplementace, typ III znamená chronické střevní selhání vedoucí k trvalé závislosti na parenterální suplementaci. Z hlediska postresekčních stavů se SBS dělí anatomicky na typ I (terminální jejunostomie), typ II (jejuno- nebo ileokolická anastomóza) a typ III (jejunoilická anastomóza). Příčinou selhání střeva jsou postresekční stavy, střevní píštěle, poruchy motility, mechanické obstrukce a abnormality střevní mukózy.
Prevalence SBS je podle registru domácí parenterální výživy v ČR 5,9 a incidence 1.,6 na 100 000 obyvatel. Etiologie je u dospělých nejčastěji rozsáhlá chirurgická resekce pro Crohnovu chorobu, akutní tepenný uzávěr a postradiační enteritida. Pro další osud nemocného je zásadní nejen zbylá délka tenkého střeva, ale také jeho anatomická část, zachování ileocekální chlopně a kontinuita tenkého střeva s kolon. Nejzávažnějším postresekčním stavem je terminální jejunostomie, jejunoileální anastomóza s méně než 35 cm celkové délky střeva a jejuno- nebo ileokolická anastomóza. Resekce jejuna je přes vysoké ztráty elektrolytů obvykle lépe tolerována než resekce ilea: po jeho resekci dochází k deficitu vitaminu B12 a solí žlučových kyselin s rozvojem sekundární steatorey a porušením vstřebávání vitaminů rozpustných v tucích a dále riziku bakteriálního přerůstání v tenkém střevě. Adaptační proces po rozsáhlých resekcích trvá měsíce až roky a spočívá především ve zvýšení absorpční plochy hypertrofií klků.
Komplikace SBS jsou podmíněné anatomickým defektem, porušením střevních funkcí a parenterální výživou. Hepatobiliární komplikace u pacientů léčených parenterální výživou mohou progredovat ve fibrózu až cirhózu, další komplikací je cholelithiáza. D lithilaktátová acidóza vzniká na podkladě metabolizace nevstřebaných sacharidů G+ střevními bakteriemi v tlustém střevě na dále nemetabolizovatelný D izomer laktátu. U pacientů se SBS s intaktním tračníkem dále dochází ke zvýšenému vstřebávání oxalátů s rizikem hyperoxalurie a nefrolithiázy. Závažnou komplikací SBS je metabolická kostní nemoc na podkladě poruchy vstřebávání a metabolismu vitaminu D a vápníku. Další komplikace jsou spojeny s parenterální výživou (katétrové sepse, trombózy velkých žil, metabolické komplikace, renální dysfunkce, poruchy kognitivních funkcí, neurologické komplikace aj.).
V časné pooperační terapii je rozhodující úplná parenterální výživa a dodávka krystaloidů. Farmakologicky je indikována suprese produkce HCl (inhibitory protonové pumpy), tlumení motility a střevní sekrece (somatostatin a jeho analoga) a symptomatická léčba (loperamid, cholestyramin). Zásadní je časná stimulace adaptace ponechané části tenkého střeva perorálním příjmem nebo enterální výživou. Odděluje se pevná strava od nápojů a používají se nápoje s vyšším obsahem sodíku. Významnou změnou pro prognózu pacientů se SBS je využití analog GLP-2, které vedou k hypertrofii střevní sliznice a významnému zvětšení absorpční plochy. Tak je možné podstatně redukovat objem parenterální výživy a u některých pacientů dosáhnout plné nezávislosti.
Transplantace tenkého střeva je indikována především u dětí s vrozenými vadami GIT.
SHRNUTÍ – Výživa u selhání střeva
-
- rozlišuj typy SBS;
- kontroluj bilanci elektrolytů;
- pozor na karence;
- ochraňuj cévní vstupy;
- pro DPV referuj pacienta do nutričního centra.
Výživa u akutní pankreatitidy
Etiologie akutní pankreatitidy je nejčastěji biliární a etylická, méně častým vyvolávajícím mechanismem je hypertriglycerideme, ERCP, některé léky a trauma. Při přijetí je nutné identifikovat pacienty v již existující malnutrici, kteří vyžadují intenzivnější přístup k nutriční intervenci. Při lehké pankreatitidě je možné po odeznění původní symptomatologie zahájit perorální příjem pankreatickou dietou, případně současně s enzymovou substitucí. Průběh těžké akutní pankreatitidy je determinován systémovou zánětlivou odpovědí a komplikacemi, často s rozvojem MODS. Při zachované funkci GIT iniciujeme časnou enterální výživu (kontinuálně, 20 ml/h) 2.–3. den po přijetí cestou nazogastrické nebo nazojejunální sondy za použití polymerní enterální formule. Enterální výživa je prioritní, avšak ne vždy se daří dosáhnout její plné dávky během několika dnů a pacient je ohrožen kumulativní negativní energetickou a proteinovou bilancí. V tomto případě po dalších 2–3 dnech zahajujeme suplementární parenterální výživu k doplnění nutričních cílů. Při úpravě stavu pacienta přecházíme na plnou enterální výživu a postupně převádíme na pankreatickou dietu. Pacienti se závažnými dlouhodobými komplikacemi (pseudocysty) profitují při dlouhodobé enterální výživě, kterou lze realizovat i ambulantně.
U pacientů s chronickou pankreatitidou volíme nízkotučnou šetřicí dietu s dostatečnou enzymovou substitucí.
SHRNUTÍ – Výživa u akutní pankreatitidy
-
- výživa se řídí závažností stavu, nespěchej;
- u lehké AP začni p.o. tekutinami a ONS, postupně zatěžuj;
- těžká AP s MODS se řídí zásadami pro nutrici kriticky nemocných;
- preferuj enterální cestu, eventuálně doplň SPN.
Nutriční postupy při snížené funkci ledvin
U hospitalizovaných pacientů se sníženou funkcí ledvin se přívod bílkovin ve stravě řídí aktuální potřebou nemocných a většinou se neomezuje. Doporučovaný příjem bílkovin ovlivňuje stadium renální insuficience, ztráty bílkovin do moči nebo potřeba náhrady ledvinných funkcí. Současná doporučení pro příjem bílkovin u pacientů ve stadiu 4 a 5 chronické renální insuficience bez potřeby hemodialýzy jsou 0,8–1,0 g/kg tělesné hmotnosti, u pacientů na hemodialýze 1,0–1,4 g/kg tělesné hmotnosti a pro pacienty na peritoneální dialýze 1,0–1,2 g/kg tělesné hmotnosti. Důraz se klade na kvalitu bílkovinných zdrojů, a proto jen výjimečně zařazujeme uzeniny, naopak preferujeme libové maso, mléčné výrobky s nižším obsahem fosforu (např. zakysané mléčné výrobky bez příchuti, čerstvý sýr) a vaječnou bílkovinu.
U pacientů s pokročilou nedostatečností ledvin je častým problémem vysoká hladina fosforu, při které v dietě omezujeme zdroje fosforu s nízkou nutriční hodnotou (kolové nápoje, hořká čokoláda, mléčné nápoje, tavené sýry, pudinky a jogurty, uzeniny, paštiky, vnitřnosti, tučné ryby, pečivo obsahující fosfátová aditiva, luštěniny, celozrnné výrobky, olejnatá semena a ořechy, houby, mák atd.).
Při vysoké hladině draslíku omezujeme v dietě jeho zdroje, zejména ovoce, zeleninu, luštěniny. U pacientů s rozdílnou mírou potřeb je velmi vhodné zavést individuální (výběrovou) dietu ve spolupráci s nutričním terapeutem. Pacienti v chronickém dialyzačním programu vyžadují odlišný přístup ke stravování. Protein v dietě neredukujeme (doporučená dávka 1,2 g/kg IBW), příjem tekutin je závislý na zbytkové diuréze a mezidialyzačním hmotnostním přírůstku. Žádoucí je snížení příjmu draslíku a fosfátů. Udržení tělesné kondice je zásadním předpokladem uchování aktivní svalové hmoty.
U dialyzovaných neprospívajících pacientů lze indikovat intradialyzační parenterální výživu, pro kterou lze opakovaně využít časového okna během výkonu. Kompozice vaku AIO pro IPV obvykle odpovídá 15–20 kcal/kg IBW (glukóza a tuková emulze) a 0,5–1,0 g proteinu/kg IBW (pro pacienta s hmotností 70 kg tedy 1 000–1 400 kcal a 35–50 g aminokyselin) s koncentrací sodíku 75 mmol/L v objemu 1 000 ml. Výživa se aplikuje v průběhu dialýzy (4 hodiny) do venózního setu konstantní rychlostí 250 ml/h a s odpovídajícím nastavením ultrafiltrace.
SHRNUTÍ – Nutriční postupy při snížené funkci ledvin
-
- nízkobílkovinná dieta při CKD, ketoanaloga aminokyselin;
- pozor na draslík a fosfát;
- využij nutričního terapeuta;
- u nemocných v dialyzačním programu dbej na dostatek proteinu;
- mysli na možnost intradialyzační PN.
Výživa při dysfagii
Důsledkem dysfagie je podvýživa, dehydratace a život ohrožující aspirace. Vyskytuje se v různém stupni závažnosti až u 70 % seniorů v zařízeních sociální péče. Dysfagie bývá způsobena neurologickými a neuromuskulárními poruchami, tumory nebo jejich léčbou v kritické oblasti i autoimunitními chorobami. Nejčastějšími příčinami jsou cévní mozkové příhody a tumory orofaciální oblasti.
Normální polykací akt má fázi orální, faryngeální a ezofageální. Postižení orální fáze zahrnuje ztížené otevírání úst, poruchy dentice a porušenou anatomii nebo motilitu jazyka. Faryngeální fáze se týká souhry polykacího pohybu s uzávěrem dýchacích cest, pohybem laryngu a kontrakcí faryngu. Ezofageální fáze zahrnuje pasáž stravy jícnem. Každá z těchto fází vyžaduje odlišný terapeutický přístup.
Ve většině doporučení se uvádí stejný algoritmus nutriční péče: diagnostika stupně dysfagické poruchy, vyhodnocení nejvhodnější nutriční strategie, konzultace nutričního terapeuta, obohacení stravy, přidání modulových dietetik, popíjení perorálních nutričních doplňků, enterální, eventuálně parenterální výživa. Vyšetření u dysfagického pacienta patří do kompetence klinického logopeda s použitím základních testů (vodní test, GUSS – gugging swalowing screen) a speciálních vyšetření (videofluoroskopie, flexibilní endoskopické vyšetření – FEES).
Cílem léčby je zajistit bezpečnou výživu orální cestou nebo za použití alternativní cesty dodávky výživy do horní části trávicího traktu (nazogastrická sonda, perkutánní endoskopická gastrostomie). U pacientů s méně závažným stupněm dysfagie lze použít standardizovaný systém diet založený na úpravě textury stravy.
SHRNUTÍ – Výživa při dysfagických poruchách
-
- aspirace ohrožuje život;
- diagnostikuj stupně dysfagické poruchy, pozvi logopeda;
- zvol vhodnou nutriční strategii, využij modifikaci textury stravy;
- PEG jako dlouhodobé řešení.
Výživa u obézních nemocných
Obezita je chronické onemocnění označované jako ABCD (adipose tissue chronic disease) a charakterizované zvýšenou hmotou tukové tkáně. Postihuje cca 25 % české populace a často je spojeno s dalšími komorbiditami, především v rámci metabolického syndromu. Podle BMI se rozlišuje obezita I. stupně (BMI 30–34,9), II. stupně (BMI 35–39,9) a III. stupně (BMI nad 40). Obezita je spojena se zvýšenou mortalitou z kardiovaskulárních i nádorových příčin (4×, resp. 2×). U pacientů s pokročilými komorbiditami a sníženou pohyblivostí dochází současně k úbytku svalové tkáně a vzniku sarkopenické obezity, která výrazně zhoršuje životní prognózu.
Pro cílenou hmotnostní redukci obézního pacienta je vhodná spolupráce s nutričním terapeutem a případně obezitologem. Nutriční terapie obezity spočívá v omezení příjmu energie při zachovaném nebo zvýšeném příjmu proteinu. Všeobecná dietní doporučení zahrnují vynechání alkoholu, slazených nápojů a sladkostí, omezení tuku v jídle a zvýšení příjmu ovoce a zeleniny. Dieta s omezením tuků obsahuje maximálně 30 % energie ve formě tuku, tzn. 33 g tuku na 1 000 kcal. Nízkosacharidová dieta obsahuje 30–130 g sacharidů denně, což odpovídá 130–540 kcal/den. Vysokoproteinové diety obsahují více než 25 % energie z bílkovin. Tyto diety se doporučují pro vyšší sytící efekt a stimulaci termogeneze. Fyzická aktivita je nedílnou součástí terapie obezity. Při redukci hmotnosti tvoří ztráta svalové tkáně přibližně 25 % redukované váhy. Pokud je do léčby zařazena systematická tělesná aktivita, je tento rozdíl pouze 13 %.
U obézních pacientů na JIP je základním nutričním principem redukce energie a zvýšený příjem proteinu. Guidelines v současné době udávají 15–20 kcal/kg energie vztažené na BMI a 1,2–2,0 g proteinu/kg IBW. Přesnější je výpočet podle adjustované tělesné hmotnosti (Petersonova rovnice, Penn State rovnice). Pro obézní nemocné v kritickém stavu se doporučuje použít indirektní kalorimetrii.
V dlouhodobé terapii obezity je nutné věnovat pozornost tzv. jo-jo efektu, kdy po prvotním úspěšné hmotnostní redukci pacient obvykle uvolňuje nastavené dietní návyky a postupně dochází k nárůstu hmotnosti. Dietní opatření a fyzická aktivita jsou zásadními podmínkami pro úspěšné celoživotní udržení dosažené váhy a tělesné konstituce.
SHRNUTÍ – Výživa u obézních nemocných
-
- pozor na sarkopenickou obezitu;
- pro stanovení potřeb použij adjustovanou tělesnou hmotnost;
- energie 15–20 kcal/kg, protein 1,2–2,0 g/kg.
Poruchy příjmu potravy
Poruchy příjmu potravy jsou primárně psychiatrická onemocnění spojená s různým stupněm malnutrice, patologickým stravovacím chováním, se zdraví ohrožujícími změnami hmotnosti a purgativním jednáním. Klasickými diagnózami jsou mentální anorexie a bulimie (vyskytující se často v kombinaci), ale i některé alternativní způsoby výživy, např. ortorexie. Mentální anorexie postihuje až 6 % žen a 0,3 % mužů s narůstající incidencí. Mortalita se udává 2,8× vyšší ve srovnání s populací. Diagnostická kritéria spočívají v detekci psychopatologického jednání (permanentní snaha o snižování hmotnosti, strach z tloušťky i při podváze, zkreslené představy o postavě) a somatických projevů (porucha hypothalamo-hypofyzární-gonádové osy, amenorea, opoždění růstu v adolescenci, projevy karence mikronutrientů). Stupeň závažnosti mentální anorexie se určuje na podkladě BMI, od mírného (BMI nad 17) po extrémní (BMI pod 15). Mentální anorexie má formu restriktivní a purgativní, často v kombinaci. Kromě somatických a endokrinních projevů jsou pacienti ohroženi zvýšeným výskytem komplikací (infekčních, kardiovaskulárních, neurologických) a komorbidit.
Terapie poruch příjmu potravy je primárně psychiatrická a spočívá na kognitivně-behaviorálních principech. U těžkých až extrémních forem mentální anorexie jsou indikovány různé formy nutriční intervence od monitorovaného perorálního příjmu pod dohledem, ONS, enterální výživy až po suplementární nebo kompletní parenterální výživu. Při intervenci je třeba brát v úvahu nonkomplianci pacientek a snahy o manipulaci při monitoraci příjmu potravy, kontrolním vážení a manipulaci při aplikaci enterální výživy. Po zahájení nutriční terapie, především formou parenterální a enterální výživy, je nutné očekávat symptomy realimentačního syndromu. Monitorace fosfatemie a suplementace nitrobuněčných kationtů (především fosfátu, draslíku a hořčíku) spolu s thiaminem je nutná.
SHRNUTÍ – Poruchy příjmu potravy
-
- současný zánětlivý proces významně zvyšuje mortalitu;
- pozor na refeeding syndrom;
- kontroluj zacházení s potravou.
Organizace nutriční péče v ČR
Systém vzdělávání v oboru Klinická výživa a intenzivní metabolická péče
Nástavbový obor Klinická výživa a intenzivní metabolická péče
Cílem vzdělávání v nástavbovém oboru klinická výživa a intenzivní metabolická péče je získat zvláštní specializovanou způsobilost osvojením potřebných teoretických znalostí a praktických dovedností, které musí ovládat lékař se specializací v oboru klinické výživy (enterální, parenterální), dietologie, intenzivní a běžné metabolické péče.
Podmínkou pro zařazení do nástavbového oboru Klinická výživa a intenzivní metabolická péče je získání specializované způsobilosti v klinickém oboru.
Vzdělávání v nástavbovém oboru probíhá u poskytovatelů zdravotních služeb akreditovaných podle zákona č. 95/2004 Sb. Celková délka přípravy v oboru Klinická výživa a intenzivní metabolická péče je 12 měsíců. Praktická část vzdělávacího programu sestává z povinné odborné praxe na pracovištích akreditovaných v oboru KVIMP a splňujících podmínky stanovené vzdělávacím programem. Teoretická část vzdělávacího programu sestává z povinné účasti na vzdělávacích aktivitách: kurz Klinická výživa a intenzivní metabolická péče I. a II. část, z kurzů předepsaných MZ ČR a účasti na vědeckých a vzdělávacích akcích domácích i zahraničních a garantovaných SKVIMP, IPVZ, ČLK, lékařskými fakultami nebo akreditovanými pracovišti.
Vzdělávání probíhá pod vedením přiděleného školitele v akreditovaném zařízení za průběžného hodnocení školitelem v průkazu odbornosti (logbook). Předpoklady přístupu k závěrečné zkoušce jsou absolvování požadované praxe potvrzené všemi školiteli, předložení potvrzení o provedených výkonech, potvrzení o absolvování kurzů a vzdělávacích akcí a úspěšné absolvování testů v rámci odborného kurzu Klinická výživa a intenzivní metabolická péče I. a II. Vlastní závěrečná zkouška sestává z teoretické části (3 odborné otázky ústní formou) a praktické části (rozbor případu pacienta ústní formou).
Lékař se zvláštní specializovanou způsobilostí v oboru Klinická výživa a intenzivní metabolická péče (nutricionista):
- je schopen samostatné činnosti v tomto oboru ve všech typech zdravotnických zařízení jak v ambulantním, tak lůžkovém zařízení nebo ve vlastním sociálním prostředí pacienta;
- poskytuje přímou péči nebo provádí konziliární činnost pro jiné obory a podílí se na vzdělávání specialistů v tomto oboru i ostatních zdravotnických pracovníků;
- na podkladě potvrzení o jejím získání je oprávněn získat funkční licenci F016 České lékařské komory.
Znalosti a kompetence lékaře se zvláštní specializovanou způsobilostí v oboru Klinická výživa a intenzivní metabolická péče (nutricionista) nad rámec základní atestace:
- specifika nutriční a metabolické péče v intenzivní péči, chirurgii, gastroenterologii, nefrologii, neurologii, onkologii, pediatrii, gerontologii;
- metody měření a výpočtů energetické potřeby a potřeby proteinu v klinických podmínkách;
- vyšetřovací metody v klinické výživě a intenzivní metabolické péči;
- způsoby a aplikace nutriční intervence v kritickém stavu, rehabilitační fázi, u chronických chorob;
- metody nutriční podpory a jejich indikace (dietoterapie, enterální, parenterální výživa);
- enterální výživa – patofyziologie, metodika a přípravky, aplikace, kontraindikace a komplikace;
- parenterální výživa – patofyziologie, metodika a přípravky, aplikace, kontraindikace a komplikace;
- farmakologické účinky nutričních substrátů, vitamíny a stopové prvky;
- vnitřní prostředí, metabolismus elektrolytů během nutriční podpory a refeeding syndrom;
- klinický management infuzní terapie a volumové náhrady;
- nutriční intervence u kriticky nemocných a multiorgánová dysfunkce;
- logistika hospitalizační a ambulantní nutriční a metabolické intervence;
- systém stravování v nemocnici, nemocniční stravovací systém;
- intervenční vstupy pro enterální a parenterální výživu;
- měření dynamických nutričních parametrů;
- vedení nutričního týmu zdravotnického zařízení.
Funkční licence České lékařské komory F016)
Vzdělávací program funkční licence ČLK F016 je určen pro lékaře se specializovanou způsobilostí v základním klinickém oboru, kteří mají hlubší zájem o obor klinické výživy a metabolické péče.
Funkční licence nenahrazuje odbornou způsobilost v nástavbového oboru Klinická výživa a intenzivní metabolická péče. Funkční licence F016 je pro poskytovatele a plátce zdravotní péče dokladem o odborné kompetenci v klinické výživě. Její držitel je tak oprávněn k preskripci klinické výživy (parenterální výživa v nemocniční a ambulantní sféře), odborné činnosti v ambulanci klinické výživy a konziliární činnosti v nemocnici a ambulanci, včetně zařízení sociální péče. Předpokladem je absolvování vzdělávacího programu sestávajícího z I. a II. části kurzu Klinická výživa a intenzivní metabolická péče s úspěšným zvládnutím závěrečných testů a z dvoutýdenní stáže na akreditovaném pracovišti v oboru KVIMP.
Podmínky k předložení žádosti o získání funkční licence F016 musí obsahovat:
- kopii dokladu o získání specializované způsobilosti v některém ze základních oborů;
- kopii dokladu o absolvování minimálně dvoutýdenní stáže na akreditovaném školicím pracovišti pro funkční licenci F016 (seznam školitelů s platnou licencí viz www.skvimp.cz);
- doklad potvrzující absolvování přípravných kurzů pro funkční licenci F016;
- dotazník SKVIMP k žádosti o F016 (skvimp.cz/soubory/dotazník-licence-f016.doc) ;
- žádost ČLK o vydání licence F016 (https://www.lkcr.cz/formulare).
Žádost o vydání licence potvrzuje školitel a statutární zástupce akreditovaného pracoviště, na kterém školenec absolvoval praxi.
Funkční licence České lékařské komory F016 je udělována lékaři se zvláštní specializovanou způsobilostí v oboru Klinická výživa a intenzivní metabolická péče (nutricionista) na podkladě potvrzení o jejím získání.
Systém nutriční péče
Systém nutriční péče je komplexní systém zabezpečující vyhledávání pacientů v nutričním riziku, vyšetření nutričního stavu pacienta, stanovení cílů nutriční péče a vypracování nutričního plánu k jejich dosažení, poskytování stravy, tekutin a umělé výživy podle potřeb pacienta a v souladu s nutričním plánem, nezbytnou asistenci při jídle, monitoraci příjmu stravy a tekutin s nutriční bilancí, sledování indikátorů kvality nutriční péče a zajištění kontinuity nutriční péče s doporučením adekvátní nutriční péče. Doporučený postup pro výživu hospitalizovaných a ambulantních pacientů je uveden v Metodickém doporučení Ministerstva zdravotnictví pro nemocniční stravování (Věstník MZ ČR č. 10, 2020).
Nutriční tým zdravotnického zařízení garantuje odbornou kvalitu jeho systému nutriční péče. Jeho členy jsou nutriční terapeut, sestra, lékař nutricionista a farmaceut. Nutriční tým spolupracuje s ošetřujícím lékařem a sestrou, případně s dalšími zdravotníky. Nutriční terapeuti působí ve dvou hlavních oblastech: v klinickém/ambulantním provozu a ve stravovacím provozu. Provádějí nutriční anamnézu, vyšetřují nutriční stav pacienta, navrhují nutriční plán a jsou spoluodpovědní za jeho realizaci. Nutriční terapeuti jsou podřízeni úseku pro nelékařská zdravotnická povolání. Nutricionista je lékař s certifikovanou specializací (atestací) v oboru Klinická výživa a intenzivní metabolická péče. Alternativním uznáním specializace nutricionisty je funkční licence České lékařské komory F016 v oboru Umělá výživa a metabolická péče. Tuto licenci uděluje ČLK po absolvování vzdělávacího programu a na základě vyjádření Společnosti klinické výživy a intenzivní metabolické péče ČLS JEP, která posoudí odbornou způsobilost lékaře.
Lékař nutricionista je pak oprávněn pacientům předepisovat enterální a parenterální výživu a vykazovat s tím spojené výkony pro úhradu pojišťovnou.
Klinický farmaceut zajišťuje dostupnost přípravků enterální a parenterální výživy a garantuje předpoklady jejich bezpečného podávání včetně informací o interakcích mezi léky a potravinami a je kompetentní v přípravě vaků all-in-one pro parenterální výživu v ústavní lékárně.
Kdo je nutriční terapeut
Nutriční terapeuti jsou uznávanými zdravotnickými odborníky na výživu a dietologii, kteří významně přispívají ke zlepšení nutričního stavu populace. Jsou rovnocennými členy terapeutických a jiných odborných týmů, v praxi aplikují vědecky podložené poznatky, podílejí se na výzkumu, úzce spolupracují s jinými odbornými společnostmi, vládou, vzdělávacími institucemi i průmyslem.
Nutriční terapeut
Nutriční terapeut je nelékařský zdravotnický pracovník podle zákona č. 96/2004 Sb., o nelékařských zdravotnických povoláních, stejně jako např. fyzioterapeut, optometrista či zdravotnický záchranář. Pojem nutriční terapeut navazuje na dřívější označení dietní sestra. Od roku 2005 se v tomto povolání rozlišují na nutriční asistenti se středoškolským vzděláním a nutriční terapeuti s vysokoškolským či vyšším odborným vzděláním. Toto povolání zahrnuje několik oblastí, zejména:
- odborný základ (anatomie, fyziologie, biochemie, farmakologie aj.);
- vnitřní lékařství;
- výživa v ochraně a podpoře veřejného zdraví;
- léčebná a klinická výživa;
- základy potravinářského zbožíznalství a technologií;
- obecná a nutriční toxikologie.
Uplatnění nacházejí nutriční terapeuti na lůžkových odděleních a ve specializovaných ambulancích státních i nestátních zdravotnických zařízení, ve stravovacích provozech zdravotnických a sociálních zařízení a zařízeních školního stravování, v lázeňské péči, v akademickém sektoru a v dalších institucích zabývajících se vědou, vývojem a inovacemi. Nemusí však pracovat jen v přímé péči o pacienta; mohou být též pracovníky Státního zdravotního ústavu, krajských hygienických stanic či Ministerstva zdravotnictví.
Více informací najdete zde: https://www.cant.cz/seznam-ambulanci/, https://nutricniterapeuti.cz/about
Klinický nutriční terapeut je název odbornosti nutričního terapeuta, který absolvoval specializační vzdělání v oboru Výživa dospělých a dětí buď formou navazujícího magisterského studia, nebo absolvováním vzdělávacího programu v Národním centru ošetřovatelství a nelékařských zdravotních oborů (NCO NZO).
DRG markery
DRG (Diagnosis Related Group) marker představuje pomocný kód systému CZ-DRG umožňující získat doplňující informaci o hospitalizačním případu (HP), která je nedostupná v rámci informací obsažených ve standardním výkaznictví akutní lůžkové péče. Z původně tří sad navrhovaných DRG markerů byly schváleny od 1. 1. 2023 dva markery a to „Provedení nutričního screeningu – pozitivní výsledek (91938)“ a „Provedení nutričního screeningu – negativní výsledek“ (91937). Jejich provádění je ukotveno v dokumentu Metodika použití DRG markerů v systému CZ-DRG. Zavedení DRG markerů pro nutriční screening může při jejich vykazování poskytovateli zdravotní péče znamenat celorepublikový sběr dat o rizikových pacientech s jednotnou metodikou, centrální uložiště v databázích NZIS (Národní zdravotnický informační systém) pod správou ÚZIS (Ústav zdravotnických informací a statistiky) a identifikaci pacientů s pozitivním nutričním screeningem, což v NZIS umožní monitoring potřeby péče nutričních terapeutů (geograficky, podle typu nemocnic…), komplexní demografický/klinický/nákladový popis populace pacientů, kteří vyžadují nutriční péči, sledování souvislosti výsledků léčby jiných onemocnění s nutričním rizikem a navazující péčí a další. Všechna tato data jsou potřebná a nezbytná pro rozvoj nutriční péče v systému zdravotní péče ČR.
Nutriční ambulance a podmínky úhrady
Nutriční ambulance
Nutriční ambulance jsou nejčastěji zřizovány při nemocnicích nebo podle potřeby ve zdravotnických zařízení, která poskytují péči pacientům s vysokým výskytem malnutrice nebo ostatních nutričně podmíněných onemocnění, např. dialyzační střediska. Nutriční ambulance se specializují na nutriční podporu podávanou v domácím prostředí, případně v pobytových zařízeních sociálních služeb. Nejčastěji se jedná o domácí enterální výživu.
Nutriční ambulance v rámci nutričních center se zaměřují také na domácí parenterální výživu. Pojišťovny hradí domácí parenterální výživu pouze v centrech domácí parenterální výživy (DPV).
Lékař nutriční ambulance musí být držitelem funkční licence ČLK F016, aby splnil podmínky pojišťovny pro uzavření smluvního vztahu se zdravotnickým zařízením. Společnost klinické výživy a intenzivní metabolické péče (SKVIMP) doporučuje, aby vedoucí lékař nutriční ambulance byl nutricionista s nástavbovou specializací z klinické výživy a intenzivní metabolické péče (KVIMP). Sestra, která pracuje v nutriční ambulanci, by měla mít zvláštní odbornou způsobilost pro činnosti v oblasti enterální a parenterální výživy, případně hojení ran nebo stomické péče. Toto platí zejména pro centra DPV. Pro nutriční ambulanci je velmi výhodná spolupráce s ambulancí nutričního terapeuta. Aktuální seznam nutričních ambulancí s jejich kontakty je dostupný na internetových stránkách SKVIMP.cz: http://www.skvimp.cz/nutricni-ambulance/.
Co poskytuje nutriční ambulance?
Nutriční ambulance se zaměřují na diagnostiku malnutrice a nutriční podporu pacientů v malnutrici nebo s vysokým rizikem malnutrice v domácím prostředí nebo v pobytových zařízeních sociálních služeb. Nutriční ambulance obvykle zajišťují vyšetření a zhodnocení nutričního stavu, diagnostiku malnutrice a ostatních nutričně podmíněných onemocnění a poskytování nutriční podpory (léčebná dietoterapie, pitná a sondová enterální výživa nebo parenterální výživa).
Lékař nutriční ambulance může předepsat kompletní spektrum enterální výživy s plnou nebo částečnou úhradou pojišťovny. Nutriční centra předepisují navíc i domácí parenterální výživu. Ambulantní poskytování nutriční podpory snižuje nároky na hospitalizaci pacientů, kteří by jinak museli být hospitalizováni. Určitým přechodem mezi nemocničním lůžkem a ambulancí je pobyt ve zdravotnickém zařízení v rámci jednodenní péče v denním stacionáři nutriční ambulance (ošetřovací den na 3 hodiny nebo 8 hodin).
Dietoterapie
Léčebná výživa ve formě diety je do ambulantní péče předepisována lékaři napříč specializacemi. Často se však jedná o restriktivní dietní postupy nebo postupy, které neodpovídají aktuálním dietologickým doporučením. Indikace a edukace diet i jejich zácvik jsou v gesci nutričního terapeuta, který má ze všech zdravotnických profesí pro tuto činnost nejlepší předpoklady. Zahájení dietní edukace probíhá po indikaci příslušné diety v rámci léčby buď určitého onemocnění, anebo nutričně podmíněného patologického stavu.
U léčebných diet, u kterých se jedná primárně o ovlivnění základní choroby, např. celiakie, nebo o kompenzaci základní chorobou vyvolaného stavu (dysfagie, maldigesce nebo malabsorpce) patří dietoterapie do rukou příslušných lékařů specialistů. Spolupráce s nutričními terapeuty na zavedení dietoterapie a při edukaci pacientů je v těchto případech pro lékaře velmi výhodná. Důležitým předpokladem takové spolupráce je však dostatečné vzdělání ambulantního specialisty nebo praktického lékaře v dietoterapii, aby indikace diety a nastavení s ní spojených režimových opatření odpovídalo aktuálním odborným doporučením. Nutriční terapeut je odpovědný za sestavení jídelníčků a instrukcí pro přípravu pokrmů tak, aby diety obsahovaly potřebné zastoupení živin k pokrytí nutričních potřeb pacienta. V současné době je hlavní překážkou ambulantní nutriční péče nízká dostupnost ambulantních nutričních terapeutů, která souvisí s ochotou zdravotních pojišťoven tuto péči hradit.
Domácí enterální výživa
V případě nedostatečného dietního příjmu nutriční terapeut nebo lékař indikuje obohacení stravy o modulární dietetika nebo perorální nutriční doplňky nebo sipping ve formě tzv. potravin pro zvláštní lékařské účely (PZLÚ, z angl. food for special medical purposes). Tyto přípravky PZLÚ, které jsou podávány do trávicího traktu perorálně nebo také jako sondová výživa, jsou definovány v legislativě Evropské unie v rámci Nařízení Evropského parlamentu a Rady (EU) č. 609/2013 o potravinách určených pro kojence a malé děti, potravinách pro zvláštní lékařské účely a náhradě celodenní stravy pro regulaci hmotnosti, souhrnně se v této legislativě hovoří o potravinách pro zvláštní skupiny (FSG, z angl. food for specific groups).
V souladu s ustanovením zákona č. 110/1997 Sb., o potravinách a tabákových výrobcích, podléhají potraviny pro zvláštní skupiny registraci v Registru oznámených potravin, který spravuje Ústav zdravotnických informací a statistiky (ÚZIS). Podskupina PZLÚ je definována jako „potraviny speciálně zpracované nebo připravené za účelem dietního managementu pacientů, včetně malých dětí, k použití pod lékařským dohledem; jsou určeny pro úplnou nebo částečnou výživu pacientů s omezenou, poškozenou nebo porušenou kapacitou přijímat, trávit, vstřebat, metabolizovat nebo vyloučit běžnou stravu nebo určité živiny v ní obsažené, nebo metabolity, nebo mají jiné lékařsky určené potřeby živin, a jejichž dietní management nemůže být zvládnut samotnou modifikací normální stravy“. Výše uvedené nařízení (EU) o FSG 609/2013 ještě doplňuje nařízení v přenesené pravomoci (EU) č. 2016/128, které upravuje požadavky na označování PZLÚ a zavádí zákaz výživových a zdravotních tvrzení na těchto potravinách. PZLÚ se dělí na tři kategorie:
- nutričně kompletní potraviny se standardním nutričním složením, které, jsou-li používány podle pokynů výrobce, mohou být jediným zdrojem pro výživu osob, pro něž jsou určeny;
- nutričně kompletní potraviny s upraveným nutričním složením určeným pro chorobu, poruchu nebo zdravotní stav, které, jsou-li používány podle pokynů výrobce, mohou být jediným zdrojem výživy osob, pro něž jsou určeny;
- nutričně nekompletní potraviny se standardním složením nebo se složením nutričně upraveným pro chorobu, poruchu nebo zdravotní stav, které nejsou vhodné jako jediný zdroj výživy.
Ceny a úhrady
Maximální ceny, výši a podmínky úhrady přípravků PZLÚ stanovuje Státní ústavu pro kontrolu léčiv, SÚKL Přehledy. Předpis PZLÚ v souladu s indikačními omezeními na recept k úhradě ze zdravotního pojištění zajišťuje nejčastěji lékař s funkční licencí F016. V přesně vymezených indikacích má oprávnění k tomuto předpisu PZLÚ i lékař specialista bez nutriční specializace (indikační omezení úhrady), a to u konkrétních referenčních skupin PZLÚ podle Vyhlášky o seznamu referenčních skupin 384/2007 Sb. (onkolog, neurolog, chirurg, geriatr a nefrolog) – Referenční skupiny PZLÚ – TS 108 Enterální výživy.
Tabulka 1: Referenční skupiny potravin pro zvláštní lékařské účely (terapeutická skupina 108 – Výživa – enterální výživy)*
| Číslo ref. skupiny | Název referenční skupiny | ATC skupina / skupiny |
|---|---|---|
| 108/1 | Polymerní výživa standardní v tekuté formě | V06EA1 |
| 108/2 | Polymerní výživa standardní hyperkalorická | V06EB01 |
| 108/3 | Polymerní výživa standardní s doplňkem vlákniny izokalorická | V06EB02 V06EB04 |
| 108/4 | Polymerní výživa standardní s doplňkem vlákniny hyperkalorická | V06EB02 V06EB04 |
| 108/5 | Polymerní výživa speciální hyperkalorická bez tuku | V06EB03 |
| 108/6 | Polymerní výživa speciální hyperkalorická s doplňkem proteinu anebo proteinu a vlákniny | V06EB05 V06EB06 |
| 108/7 | Polymerní výživa speciální určená pro léčbu jaterního selhání | V06EB10 |
| 108/8 | Polymerní výživa speciální s doplňkem proteinu, argininu a zinku | V06EB11 |
| 108/9 | Polymerní výživa speciální s doplňkem imunonutrientů a antioxidantů | V06EB07, VO6EB12, V06EB13, V06EB14, V06EB15, V06EB16 |
| 108/10 | Polymerní výživa speciální diabetická | V06EB08 |
| 108/11 | Polymerní výživa speciální s doplňkem MCT olejů | V06EB09 |
| 108/12 | Oligopeptidická výživa tekutá | V06EC1 |
| 108/13 | Zahušťovadla | V06EE1 |
* Podle vyhlášky o seznamu referenčních skupin 384/2007 Sb.
Lékaři s oprávněním předpisu PZLÚ s úhradou ze zdravotního pojištění:
- lékař nutricionista s funkční licencí F016 má oprávnění předepsat sipping na celou dobu, kdy pacient potřebuje nutriční podporu, pokud pacient splňuje úhradová kritéria;
- onkolog může předepsat sipping indikovaným pacientům na dobu 1 měsíce do limitu 600 kcal/den; pak je pacient odeslán do nutriční ambulance;
- chirurg může předepsat sipping s vysokým obsahem bílkovin indikovaným pacientům na dobu 1 měsíce do limitu 600 kcal/den; pak je pacient odeslán do nutriční ambulance;
- geriatr může předepsat sipping s vlákninou indikovaným pacientům na dobu 1 měsíce do limitu 600 kcal/den; pak je pacient odeslán do nutriční ambulance.
Pacienti na dlouhodobé domácí enterální výživě jsou v naprosté většině dispenzarizováni v nutriční ambulanci. Domácí enterální výživa je podávána buď perorálně, nebo nazogastrickou či nazoenterální sondou, resp. pomocí gastrostomie nebo jejunostomie (perkutánní endoskopická nebo chirurgická).
Lékař, držitel funkční licence F016, který pracuje v nutriční ambulanci, pacienty na domácí enterální výživě pravidelně sleduje, spolupracuje s praktickým lékařem a podle základního onemocnění spolupracuje s příslušnými ambulantními specialisty. Kromě předpisu přípravků pro enterální výživu je nutriční ambulance u sondové výživy odpovědná za zajištění aplikačních pomůcek, případně enterálních pump a potřebného zdravotnického materiálu. Při aplikaci výživy enterální pumpou se vybavení pacienta plátcům vykazuje pomocí tzv. materiálového výkonu 11513, pumpou aplikovaná enterální výživa prováděná ve vlastním sociálním prostředí. Tento kód je vázán na autorskou odbornost 101, vnitřní lékařství. Nutriční ambulance, která nemá nasmlouván tento kód, má povinnost pacienta upozornit na jiné dostupné zdravotnické zařízení v regionu, které materiál na úhradu ze zdravotního pojištění poskytuje. Pokud takto informovaný pacient chce, má samozřejmě možnost si sety koupit. Aplikační materiál a PZLÚ vydaný nutriční ambulancí pro domácí výživu nejsou určeny k používání v případě hospitalizace. Nemocnice nesmí trvat na jejich využití nebo je po pacientovi požadovat.
Tabulka 2: Materiálové výkony pro pumpou aplikovanou domácí enterální a parenterální výživu
| Kód | Název výkonu | Perioda vykazování | Autorská odbornost | Specializační požadavek |
|---|---|---|---|---|
| 11511 | Parenterální výživa prováděná ve vlastním sociálním prostředí | 1 týden | 101 | F016 |
| 11512 | Parenterální výživa prováděná ve vlastním sociálním prostředí speciální mobilní pumpou | 1 týden | 101 | F016 |
| 11513 | Pumpou aplikovaná domácí enterální výživa prováděná ve vlastním sociálním prostředí | 1 den | 101 | F016 |
Odbornost 101, vnitřní lékařství; F 016, Funkční licence České lékařské komory F016 umělá výživa a metabolická péče
Domácí parenterální výživa
Domácí parenterální výživa u pacientů s chronickým intestinálním selháním je poskytována v rámci center DPV, jejichž aktuální seznam je dostupný na: http://www.skvimp.cz/pracovni-skupiny/domaci-parentalni-vyziva/centra-domaci-parentalni-vyzivy/. Centra DPV vznikají při větších nemocnicích, kde lze zabezpečit komplexní lůžkovou péči u pacientů s abdominální katastrofou, implantaci a ošetřování dlouhodobých cévních vstupů včetně komplikací, prevenci a léčbu metabolických a orgánových komplikací u pacientů s chronickým intestinálním selháním na PDV, přípravu zvláště náročných lékových forem v podobě lékárenských vaků a edukaci pacientů a všech ošetřujících osob. Indikaci DPV provádí lékař centra DPV, který musí být po propuštění pacienta na DPV do domácí péče stále telefonicky dostupný. Aplikace DPV se provádí cestou tzv. tunelizovaných katétrů, podkožních portů nebo periferně zavedených centrálních žilních katétrů (PICC). Jejich ošetřování provádí proškolení a pověření pacienti, jejich blízcí nebo sestry domácí péče. Pro DPV jsou využívány hromadně vyráběné vícekomorové vaky nebo individuální lékárenské vaky z nemocničních lékáren. Úhrada léčivých prostředků je upravena opatřeními obecné povahy SÚKL o podmínkách úhrady individuálně připravovaných parenterálních výživ pro domácí terapii podle objemu, věkové kategorie a způsobu přípravy all-in-one vaku. Veškerý zdravotnický materiál potřebný pro aplikaci DPV zajišťuje pacientům centrum DPV včetně infuzních pump a setů. Náklady spojené s jeho pořízením jsou vykazovány pomocí materiálových výkonů podle typu infuzní pumpy, která je buď statická (11511), nebo mobilní (11512).
Tabulka 3: Úhradové kódy pro léčivé prostředky u pacientů na DPV (Opatření obecné povahy SÚKL)
| Kód | Název | Doplněk názvu |
|---|---|---|
| 1401001 | Parenterální výživa all-in-one hypokalorická pro domácí terapii | Dospělí objem do 1 500 ml |
| 1401002 | Parenterální výživa all-in-one hypokalorická pro domácí terapii | Děti objem do 1 500 ml |
| 1401003 | Parenterální výživa all-in-one hypokalorická pro domácí terapii | Připravovaná před aplikací |
| 1401006 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Dospělí objem do 1 500 ml |
| 1401007 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Dospělí objem do 3 000 ml |
| 1401008 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Děti objem do 1 500 ml |
| 1401009 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Děti objem do 3 000 ml |
| 1401010 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Připravovaná před aplikací |
| 1401011 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Dospělí s nedostatečnou tolerancí základních režimů objem do 1 500 ml |
| 1401012 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Dospělí s nedostatečnou tolerancí základních režimů objem do 3 000 ml |
| 1401013 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Děti s nedostatečnou tolerancí základních režimů objem do 1 500 ml |
| 1401014 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Děti s nedostatečnou tolerancí základních režimů objem do 3 000 ml |
| 1401015 | Parenterální výživa all-in-one isokalorická pro domácí terapii | Připravovaná před aplikací – pacienti s nedostatečnou tolerancí základních režimů |
| 1401020 | Parenterální hydratační podpora pro pacienty na domácí parenterální výživě | Objem do 3 000 ml |
| 1402001 | Parenterální výživa all-in-one pro domácí terapii | Lékové zabezpečení pacienta se selháním střeva na DPV |
Užitečné zdroje a odkazy
Odborné informace a guidelines
- ESPEN
- ASPEN (nutritioncare.org)
- Doporučené postupy – Guidelines – SKVIMP
- Dokumenty, informace pro praxi – SKVIMP
- 31. INDIKACE NUTRIČNÍ PODPORY ONKOLOGICKY NEMOCNÝCH » Linkos.cz
- Nutriční péče » Linkos.cz
- Výživa v onkologii e-learning: onkonutrice
Diagnostické nástroje
- Mezinárodně používané screeningové dotazníky najdete zde: NutriScreen – Nutritional Risk Screening Instruments (clinicalnutrition.science)
- Dotazník hodnocení nutričního rizika » Linkos.cz
- 11378_dotaznik_nutrition_CZ.indd (nestlehealthscience.cz)
Seznam nutričních ambulancí a ambulancí nutričních terapeutů
- Nutriční ambulance – SKVIMP
- https://www.cant.cz/seznam-ambulanci/
- https://www.nutricniterapeuti.cz/clanky/nutricni-terapeuti-cr/
Předpis enterální výživy s úhradou pojišťoven mimo nutriční ambulance – podmínky
Chirurg
Možnost preskripce sippingu chirurgem od 1. 5. 2020 – Česká chirurgická společnost (chirurgie.cz)
strucny-navod-k-preskripci-sippingu-chirurgem.pdf (chirurgie.cz)
Onkolog
Připomenutí možnosti preskripce sippingu onkologem » Linkos.cz
Doporučené publikace



